
【题目】“瑞德西韦(Remdesivir)”对新型冠状病毒(SARS-CoV-2)有明显的抑制作用,其合成路线如下:
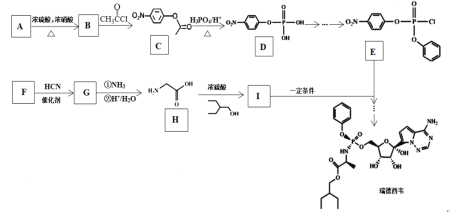
已知:![]()
(1)有机物G中官能团名称是________、_________。
(2)有机物H的化学名称为____________。
(3)A到B的反应类型是___________。
(4)有机物F的结构简式是__________。
(5)写出由B到C的反应方程式_________________。
(6)有机物M是C的一种同分异构体,满足下列条件的同分异构体有___种;其中核磁共振氢谱有4组峰,峰面积之比为2:2:2:1的结构简式为____________。
①苯环上有3个取代基 ②能发生银镜反应
③不能与FeCl3发生显色反应 ④能发生水解反应,且1 mol M消耗4 mol NaOH
(7)设计由苯甲醇为原料制备化合物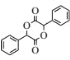 的合成路线______(无机试剂任选)。
的合成路线______(无机试剂任选)。
【答案】氰基 羟基 氨基乙酸(或甘氨酸) 取代反应 HCHO ![]() +
+![]()
![]()
![]() +HCl 6
+HCl 6 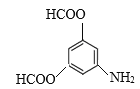 、
、
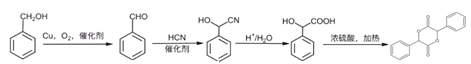
【解析】
A发生取代反应生成B,B发生取代反应生成C,根据C结构简式可知,B为![]() ,则A为
,则A为![]() ,D与SOCl2在催化剂存在时发生反应产生
,D与SOCl2在催化剂存在时发生反应产生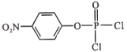 再与
再与![]() 发生取代反应产生E:
发生取代反应产生E: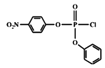 ;F与HCN发生信息的加成反应生成G,G发生取代反应、水解反应产生H,根据H结构简式知G为HOCH2CN,F为HCHO,H与
;F与HCN发生信息的加成反应生成G,G发生取代反应、水解反应产生H,根据H结构简式知G为HOCH2CN,F为HCHO,H与![]() 发生酯化反应生成I:
发生酯化反应生成I: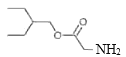 ,E、I发生取代反应生成
,E、I发生取代反应生成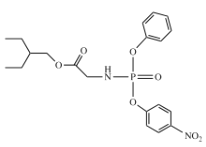 ,该物质经一系列转化得到瑞德西韦;
,该物质经一系列转化得到瑞德西韦;
(7)以苯甲醇为原料制备化合物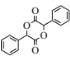 ,
, 可由
可由![]() 发生酯化反应得到,
发生酯化反应得到,![]() 可由
可由![]() 水解得到,苯甲醛和HCN发生加成反应得到
水解得到,苯甲醛和HCN发生加成反应得到![]() ,苯甲醇发生氧化反应生成苯甲醛。
,苯甲醇发生氧化反应生成苯甲醛。
根据上述分析可知:A为![]() ,B为
,B为![]() ,F为HCHO,G为HOCH2CN,I为
,F为HCHO,G为HOCH2CN,I为 。
。
(1)有机物G结构简式是HOCH2CN,可见G中官能团名称为氰基、羟基;
(2)根据流程图可知有机物H结构简式是![]() ,其化学名称为氨基乙酸(或甘氨酸);
,其化学名称为氨基乙酸(或甘氨酸);
(3)A为![]() ,名称为苯酚,苯酚与浓硝酸、浓硫酸混合加热,发生苯环对位上的取代反应产生B:
,名称为苯酚,苯酚与浓硝酸、浓硫酸混合加热,发生苯环对位上的取代反应产生B:![]() ,故A到B的反应类型是取代反应;
,故A到B的反应类型是取代反应;
(4)根据上述分析可知有机物F的结构简式是HCHO;
(5)B为![]() ,B与CH3COCl发生取代反应产生C:
,B与CH3COCl发生取代反应产生C: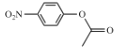 和HCl,则由B到C的反应方程式为:
和HCl,则由B到C的反应方程式为:![]() +
+![]()
![]()
![]() +HCl;
+HCl;
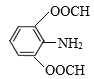
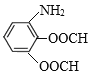
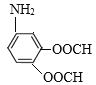
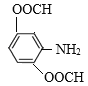
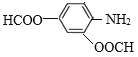
(6)C是![]() ,有机物M是C的一种同分异构体,满足下列条件:①苯环上有3个取代基;②能发生银镜反应说明含有醛基;③不能与FeCl3发生显色反应说明无酚羟基;④能发生水解反应,且1molM消耗4molNaOH,说明M中有2个甲酸与酚羟基形成的酯基HCOO-,另一个取代基是-NH2,则其可能的结构简式为:
,有机物M是C的一种同分异构体,满足下列条件:①苯环上有3个取代基;②能发生银镜反应说明含有醛基;③不能与FeCl3发生显色反应说明无酚羟基;④能发生水解反应,且1molM消耗4molNaOH,说明M中有2个甲酸与酚羟基形成的酯基HCOO-,另一个取代基是-NH2,则其可能的结构简式为: 、
、 、
、 、
、 、
、 、
、 ,共有6种,其中核磁共振氢谱有4组峰,峰面积之比为2:2:2:1的结构简式为
,共有6种,其中核磁共振氢谱有4组峰,峰面积之比为2:2:2:1的结构简式为 、
、 ;
;
(7)苯甲醇催化氧化产生苯甲醛,苯甲醛与HCN发生加成反应产生![]() ,该物质水解后酸化得到
,该物质水解后酸化得到![]() ,
, ![]() 发生酯化反应产生
发生酯化反应产生 ,故由苯甲醇为原料制备化合物
,故由苯甲醇为原料制备化合物 的合成路线为:
的合成路线为: 。
。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
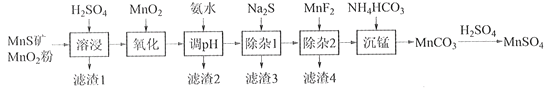
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氯芬酸钠(G)是常用的抗炎镇痛药,一种合成路线如图(-Ph为苯基):
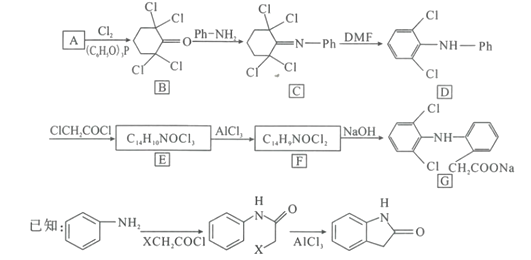
回答下列问题:
(1)9.8gA完全燃烧生成26.4gCO2和9.0gH2O,且A的核磁共振氢谱中有3组峰,峰面积之比为1:2:2,则A的结构简式是___。
(2)B中的官能团名称是___。
(3)E到F的反应类型是___。
(4)写出F到G的反应方程式___。
(5)能发生银镜反应且为环状结构的A的同分异构体多达14种,写出其中只含一条侧链且侧链上的一氯代物为2种的结构简式___(不考虑立体异构)。
(6)设计由2—丙醇和对苯二胺(![]() )制备
)制备 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在地壳内SiO2和HF存在以下平衡:SiO2(s)+4HF(g)![]() SiF4(g)+2H2O(g),△H= +148.9 kJ。如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,()
SiF4(g)+2H2O(g),△H= +148.9 kJ。如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,()
A.2v(正、HF)=v(逆、H2O)B.v(H2O)=2v(SiF4)
C.SiO2的质量保持不变D.反应物不再转化为生成物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天员呼吸产生的CO2用下列反应处理,可实现其合理利用。反应Ⅰ:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
(1)己知H2(g)、CH4(g)的燃烧热分别为A kJ/mol、B kJ/mol, H2O(l)=H2O(g) △H =+C kJ/mol。计算反应Ⅰ的△H=_______kJ/mol。
(2)将原料气按n(CO2)∶n(H2)=1:4置于密闭容器中发生反应Ⅰ,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
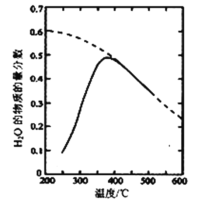
①温度过高或过低均不利于该反应的进行,原因是________。
②200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为____。(不必化简。用平衡分压代替平衡浓度计算)
(3)一种新的利用方案是Ⅱ:反应:CO2(g)+2H2(g)![]() C(s)+2H2O(g) △H
C(s)+2H2O(g) △H
①向体积为2 L且带气压计的恒容密闭容器中通入0.08 mol H2和0.04 mol CO2发生反应Ⅱ。若反应起始和平衡时温度相同(均为250℃),测得反应过程中压强(P)随时间(t)的变化如图1曲线a所示,则△H___ 0(填“>”“<”或“不确定”)
②若其它条件相同,仅改变某一条件时,测得其压强(P)随时间(t)的变化如图1曲线b所示,则改变的条件是_______。
③图2是甲、乙两同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是_______(填“甲”或“乙”),m值为______。
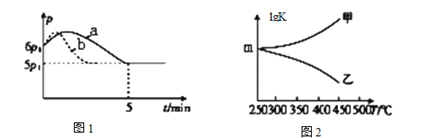
④反应Ⅱ必须在高温下才能启动,原因是______________。
(4)科学家还研究了处理CO2(g)另外的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为______________。
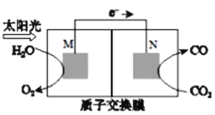
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)≒bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了B.物质A的转化率减少了
C.物质B的质量分数减小了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算填空
(1)ARn+共有x个电子,则该阳离子的中子数________。
(2)AXn-共有x个电子,则该阴离子的中子数________。
(3)已知R原子有b个中子,R2+核外有a个电子,则R原子的组成符号是________。
(4)A2-原子核内有x个中子,其质量数为m,则ng A2-所含电子的物质的量为____________。
(5)已知阴离子R2-的原子核内有x个中子,R原子的质量数为m,则Wg R原子完全转化为R2-。其中含有的电子数为________(用NA表示阿伏伽德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中,△H2>△H1的是
A.2H2(g)+O2(g)=2H2O(g) ΔH1;2H2(g)+O2(g)=2H2O(l) ΔH2
B.S(s)+O2(g)=SO2(g) ΔH1; S(g)+O2(g)=SO2(g) ΔH2
C.![]() ΔH1;C(s)+O2(g)=CO2(g) ΔH2
ΔH1;C(s)+O2(g)=CO2(g) ΔH2
D.H2(g)+Cl2(g)=2HCl(g) ΔH1; ![]() ΔH2
ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
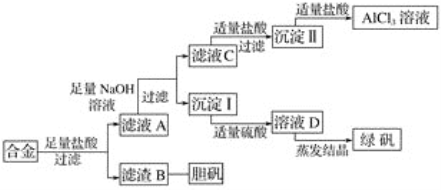
【题目】某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),其实验方案如下:
请回答下列问题:
(1)过滤用的玻璃仪器有________。
(2)小组成员经过检测,发现制得的绿矾不纯,试分析原因:_____________________________,要想由沉淀I最终制得纯度较高的绿矾,应如何改进:______________________________________________________。
(3)小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2可以使B溶解,则该反应的化学方程式为____________________________________________________。
(4)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能最终制得三种物质,你认为后者方案相对于前者方案________(填“更合理”或“不合理”),理由是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com