
| A、CO的燃烧热为-283 kJ/mol |
| B、在③反应时,若加入催化剂,可以使△H减小 |
| C、若有3.2g CH4与足量水蒸汽按③反应,则放出热量是43.2 kJ |
| D、若生成相同质量的CO2,则放出的热量C2H2大于CO |
| n |
| M |
| 3.2g |
| 16g/mol |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
| A、所用NaOH已潮解 |
| B、用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法 |
| C、有少量NaOH溶液残留在烧杯里 |
| D、向容量瓶中加水未到刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | Fe(OH)3胶体的制备 | 向沸水中逐滴加入饱和FeCl3溶液,继续煮沸至溶液呈红褐色 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制1 mol?L-1 Na2CO3溶液500 mL,将Na2CO3放在托盘天平右盘称量 |
| B、10 g 98%的硫酸(密度为1.84 g?cm-3)与10 mL 18.4 mol?L-1的硫酸的浓度是不同的 |
| C、制成0.5 L 10 mol?L-1的盐酸,需要HCl气体112 L(标准状况) |
| D、50 mL 1 mol?L-1 AlCl3溶液中的c(Cl-)与75 mL 2 mol?L-1氯化钙溶液中c(Cl-)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、按系统命名法,化合物 的名称为2,7,7-三甲基-4,4-二乙基辛烷 的名称为2,7,7-三甲基-4,4-二乙基辛烷 |
| B、在蛋白质分子中存在氨基和羧基,可通过调节溶液的pH使其形成晶体析出 |
C、1mol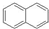 完全燃烧.消耗氧气的量为1mol 完全燃烧.消耗氧气的量为1mol 的2倍 的2倍 |
D、香芹酮的结构为: ,1mol的香芹酮最多能和2mol的氢气反应 ,1mol的香芹酮最多能和2mol的氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨工业中为了提高氢气利用率,适当增加氢气浓度 |
| B、Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 |
| C、蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室生产的Cl2进入阳极室 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、①② | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B、已知,N2(g)+3 H2(g)?2NH3(g)△H<0,为提高氨的产率,理论上应采取降低温度的措施 |
| C、反应CO(g)+NO2(g)?CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 |
| D、对于2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com