
| A. | Al3+先形成沉淀后溶解,后来再形成沉淀接着又沉淀溶解 | |
| B. | 反应后,溶液中NH4+,Fe2+,SO42-的物质的量减少,而Al3+、Cl-的物质的量不变 | |
| C. | Fe2+先被氧化并形成沉淀,后来沉淀溶解并被还原为Fe2+,最后又被氧化 | |
| D. | 该实验中共有两种气体生成 |
分析 溶液中含有NH4+,Fe2+,Al3+,SO42-,Cl-五种离子,若向其中加入过量的Na2O2,过氧化钠具有强氧化性,且与水反应生成氢氧化钠,则热并搅拌,则可生成氢氧化铁、氨气,氢氧化铝或偏铝酸钠,再通入过量的HI气体,氢氧化铝、氢氧化铁溶解,铁离子与碘离子发生氧化还原反应生成碘和Fe2+,充分反应后,最后加入足量稀硝酸酸化的硝酸钡溶液,硝酸可氧化Fe2+和碘离子,且生成硫酸钡沉淀,以此解答该题.
解答 解:A.过氧化钠与水反应生成氢氧化钠,Al3+先形成氢氧化铝沉淀,氢氧化钠过量生成偏铝酸钠而溶解,通入过量的HI气体,偏铝酸钠先与酸反应生成氢氧化铝沉淀,酸过量,氢氧化铝溶解生成铝离子,故A正确;
B.加入过氧化钠,生成氨气而挥发,最后加入过量的稀硝酸,不可能存在还原性的Fe2+,SO42-生成硫酸钡沉淀,而Al3+、Cl-的物质的量不变,故B正确;
C.Fe2+先被过氧化钠氧化并形成氢氧化铁沉淀,后来沉淀溶解并被HI还原为Fe2+,最后又被硝酸氧化,故C正确;
D.该实验中共有氧气、氨气和NO三种气体生成,故D错误;
故选D.
点评 本题考查离子反应问题,注意过氧化钠与水反应的特征,侧重于学生的分析能力的考查,为高频考点,注意常见离子的性质以及反应类型的判断,难度不大.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol苯乙烯中含有碳碳双键的数目为0.4NA | |
| B. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2[NA-N(Cl2)] | |
| C. | 一定条件下,0.1 mol SO2与足量氧气反应生成SO3,转移电子数为0.2NA | |
| D. | 电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
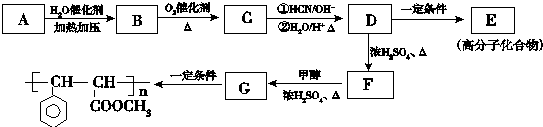
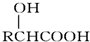
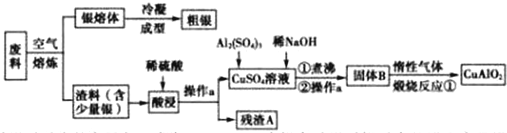
 .
. .
.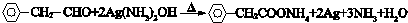 .
. .
.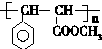 与足量氢氧化钠溶液反应的化学方程式
与足量氢氧化钠溶液反应的化学方程式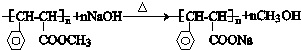 .
.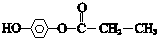 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
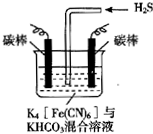 [Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )
[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )| A. | 电解时阳极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3- | |
| B. | 电解时阴极反应式为2HCO3-+2 e-═H2↑+2CO32- | |
| C. | 当电解过程中有22.4L标准状况下的H2生成时,溶液中有32gS析出(溶解忽略不计) | |
| D. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| R | T | |
| X | Y | Z |
| A. | R位于元素周期表中第二周期第VIA族 | |
| B. | 五种元素中原子序数最大的是X | |
| C. | 气态氢化物稳定性:T>Y | |
| D. | Z元素的最高价氧化物对应的水化物的化学式为H2ZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 1.5mol | C. | 2mol | D. | 2.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙醇、四氯化碳都是重要有机溶剂,都可用于提取碘水中的碘单质 | |
| B. | 可用蘸浓硫酸的玻璃棒检验输送氨气的管道是否漏气 | |
| C. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀 | |
| D. | 用量筒量取10.00mL 1.0mol/L的盐酸于100mL溶量瓶中,加水稀释至刻度,可制得0.1mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(X)>r(Y)>r(Z)>r(W) | |
| B. | X的简单气态氢化物的稳定性比W的弱 | |
| C. | X分别与Y、W形成的化合物中化学键类型相同 | |
| D. | Y的最高价氧化物对应的水化物碱性比Z的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com