
| A. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| B. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| C. | 25℃,1标准大气压下,64g SO2 中含有的原子数为3NA | |
| D. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L |
分析 A、标况下水为液态;
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、求出二氧化硫的物质的量,然后根据二氧化硫中含3个原子来分析;
D、氦气为单原子分子.
解答 解:A、标况下水为液态,故不能根据气体摩尔 体积来计算其物质的量,故A错误;
B、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氯气的物质的量小于0.5mol,故含有分子数小于0.5NA个,故B错误;
C、64g二氧化硫的物质的量为1mol,而二氧化硫中含3个原子,故1mol二氧化硫中含3NA个原子,故C正确;
D、氦气为单原子分子,故含NA个氦原子的氦气分子的物质的量为1mol,体积在标况下为22.4L,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对烃基苯甲醛的结构简式: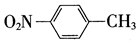 | B. | 质量数为37的氯原子:$\stackrel{37}{17}$Cl | ||
| C. | NH4Br的电子式: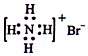 | D. | 二氧化碳分子的比例模型: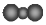 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2υ(AB)=υ(A2) | |
| B. | 容器内三种气体AB、A2、B2共存 | |
| C. | 容器中各组分的体积分数不随时间变化 | |
| D. | 单位时间内消耗n mol A2,同时消耗n mol AB |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 200mL 2mol/L MgCl2溶液 | B. | 150mL 5mol/L KClO3溶液 | ||
| C. | 标准状况下,13.44L的HCl气体 | D. | 29.25gNaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.3 |
| 密度/g•cm-3 | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 互溶 | 不溶 |
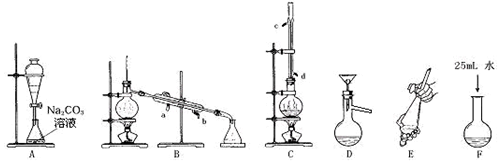
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{④}^{Na_{2}CO_{3}}$$→_{⑤}^{()}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$精盐
$→_{④}^{Na_{2}CO_{3}}$$→_{⑤}^{()}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$精盐 中填写所使用除杂试剂的化学式NaOH,在⑤中的操作名称是过滤.
中填写所使用除杂试剂的化学式NaOH,在⑤中的操作名称是过滤.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com