
|
在丹麦首都哥本哈根召开的联合国气候变化大会,焦点议题之一是发展“低碳经济”,减少温室气体排放.你认为下列做法中.不能有效减少空气中CO2含量的是 | |
| [ ] | |
A. |
开发利用太阳能、风能、生物能、海洋能等清洁能源 |
B. |
使用节能产品,推广节能环保汽车 |
C. |
植树造林,增加森林植被面积 |
D. |
用脱硫处理的煤代替原煤作燃料 |
科目:高中化学 来源: 题型:阅读理解
 2009年12月7日一18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议.而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
2009年12月7日一18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议.而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.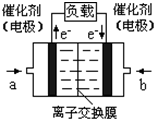 意图,则a处通入的是
意图,则a处通入的是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
2009年12月7日~18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议。而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
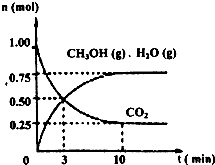
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1mol CO2和3.25mol H2,在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:

从反应开始到平衡,氢气的平均反应速
![]() (H2)=_______。
(H2)=_______。
②下列措施中一定不能使![]() (CH3OH)/ (CO2)增大的是_____。
(CH3OH)/ (CO2)增大的是_____。
A.降低温度 B.缩小容器的容积
C.将水蒸气从体系中分离 D.使用更有效的催化剂
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+的电离平衡常数K=___________。(已知:10-5.6=2.5×10-6)。
HCO3-+H+的电离平衡常数K=___________。(已知:10-5.6=2.5×10-6)。
(3)标准状况下,将1.12L CO2通入100mL 1mol·L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为
________________;
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处的通入的是_____________(填“乙醇”或“氧气”),b处电极上发生的电极反应是___________
__________________________________________。

(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(15分)2009年12月7日一18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议。而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1mol CO2和3.25molH2,在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
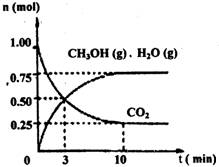
①从反应开始到平衡,氢气的平均反应速率v(H2)= 。
②下列措施中一定不能使n(CH3OH)/n(CO2)增大的是: 。
A.降低温度 B.缩小容器的容积
C.将水蒸气从体系中分离 D.使用更有效的催化剂
(2)常温常压下,饱和CO 2水溶液的pH =5.6,c(H2CO3)=1.5 ×l0-5mol·L-1。若 忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3- +H+的电离平衡常数K= 。(已知:10 -5.6=2.5×l0-6)。
(3)标准状况下,将1.12LCO2通入100mL 1mol·L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为 ;
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是 (填“乙醇”或“氧气”),b处电极上发生的电极反应是: 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省常州市高三上学期期中考试化学 题型:选择题
在丹麦首都哥本哈根召开的联合国气候变化大会,焦点议题之一是发展“低碳经济”,减少温室气体排放。你认为下列做法中.不能有效减少空气中CO2含量的是
A.开发利用太阳能、风能、生物能、海洋能等清洁能源
B.使用节能产品,推广节能环保汽车
C.植树造林,增加森林植被面积
D.用脱硫处理的煤代替原煤作燃料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com