
分析 (1)①CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,则C、O之间为三键;等电子体中原子数和价电子数都相同;
②根据结构相似相溶原理分析,非极性溶质易溶于非极性溶剂;
(2)镓是31号元素,根据核外电子排布式的书写规则书写;根据价电子排布判断电离能的大小;
(3)根据价层电子对互斥理论来判断.
解答 解:(1)①CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,则CO的结构式为C≡O,等电子体中原子数和价电子数都相同,1molCO中含2mol原子,含8mol价电子,CN-的原子数是2,价电子数都是10,则互为等电子体,
故答案为:C≡O;CN-;
②水为极性分子,硫酸镍溶液为离子化合物溶液,Ni(CO)4中Ni采取SP3杂化,是正四面体结构,所以属于非极性分子,根据相似相溶原理,非极性溶质易溶于非极性溶剂,苯和四氯化碳是非极性分子,所以Ni(CO)4易溶于苯和四氯化碳,
故答案为:bc;
(2)镓是31号元素,该原子核外有31个电子,4S能级能量小于3d能级能量,根据能量最低原理,电子先排4s能级后排3d能级,所以铜的核外电子排布式为1s22s22p63s23p63d104s24p1;Zn原子的价电子排布式为3d104s2,价电子中3d、4s轨道为全充满状态,原子较稳定,故Zn的第一电离能大于Ga,
故答案为:1s22s22p63s23p63d104s24p1;Zn原子的价电子排布式为3d104s2,体系的能量较低,原子较稳定,故Zn的第一电离能大于Ga;
(3)H2Se分子的中心原子Se原子上含有2个σ 键,中心原子上的孤电子对数=$\frac{6+1×2}{2}$=4,所以H2Se分子的VSEPR模型是四面体型,略去孤电子对后,实际上其空间构型是V型;
BBr3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=$\frac{3+1×3}{2}$=3,所以BBr3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形.
故选:d.
点评 本题考查物质的结构与性质,注重对电子排布式、等电子体、电离能、价层电子对互斥理论等考点的训练,注意高频考点的考题题型,题目难度中等.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
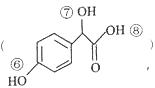 的说法正确的是( )
的说法正确的是( )| A. | Y 既能使溴水褪色又能使酸性高锰酸钾褪色,且原理相同 | |
| B. | Y 的同分异构体中,不存在苯环上的一氯代物只有一种的物质 | |
| C. | 1molY 与氢氧化钠溶液反应时,最多消耗 3mol 氢氧化钠 | |
| D. | Y 中⑥、⑦、⑧三处-OH 的电离程度由大到小的顺序是⑧>⑥>⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
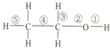 已知乙醇中不同的化学键如图,关于乙醇在各种不同反应中断裂的键的说明不正确的是( )
已知乙醇中不同的化学键如图,关于乙醇在各种不同反应中断裂的键的说明不正确的是( )| A. | 和浓H2SO4共热,140℃时键①②断裂 | B. | 在Ag催化下和O2反应键①③断裂 | ||
| C. | 和浓H2SO4共热,170℃时②⑤键断裂 | D. | 和氢溴反应键①断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸 | B. | 氨水 | C. | 硫酸 | D. | 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.3mol/(L•s) | B. | v(B)=0.6 mol/(L•s) | C. | v(C)=0.5 mol/(L•s) | D. | v(D)=0.4mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
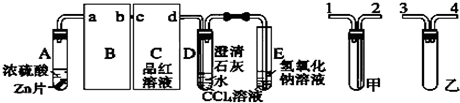
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com