
| A. | 原子半径大小:Ca>S | B. | 金属性强弱:Na<Mg | ||
| C. | 酸性强弱:HBrO4>HClO4 | D. | 碱性强弱:NaOH>KOH |
分析 A.电子层越大,原子半径越大;
B.同一周期的元素中,原子序数越大,金属性越弱;
C.非金属性越强,对应最高价氧化物的水合物的酸性越强;
D.金属性越强,最高价氧化物对应水合物的碱性越强.
解答 解:A.钙原子含有4个电子层,硫离子含有3个电子层,则原子半径Ca>S,故A正确;
B.Na和Mg位于同一周期,Mg的原子序数对应Na,则金属性Na>Mg,故B错误;
C.非金属性Cl>Br,则最高价氧化物对应水合物的酸性:HBrO4<HClO4,故C错误;
D.金属性Na小于K,则最高价氧化物对应水合物的碱性:NaOH<KOH,故D错误;
故选A.
点评 本题考查了原子结构与元素周期律的应用,题目难度不大,明确 元素周期律内容为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系.


科目:高中化学 来源: 题型:选择题

| A. | 装置甲:测定一定时间内生成H2的速率 | |
| B. | 装置乙:萃取碘水中的碘 | |
| C. | 装置丙:海水蒸馏得淡水 | |
| D. | 装置丁:测定中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
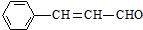 ,则关于该有机物的说法正确的是( )
,则关于该有机物的说法正确的是( )| A. | 1 mol该有机物发生银镜反应能生成 1 mol Ag | |
| B. | 1 mol该有机物最多能够与4 mol H2 发生加成反应 | |
| C. | 它与 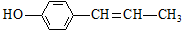 互为同分异构体 互为同分异构体 | |
| D. | 该有机物能使高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同的分子量和不同的结构 | B. | 相同的分子式和不同的结构 | ||
| C. | 相同的分子量和相同的结构 | D. | 相同的分子式和相同的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一段时间负极质量明显减轻 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 只有正极上有氢气逸出,正极电极反应式为:2H++2e-═H2↑ | |
| D. | 正极附近的SO42-离子浓度逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重水的分子式是H218O | B. | 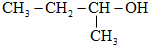 的系统命名为1-甲基-1-丙醇 的系统命名为1-甲基-1-丙醇 | ||
| C. | 氯乙烷官能团的结构式Cl | D. | 次氯酸的电子式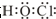 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
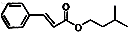 )是一种香料,一种合成路线如图:
)是一种香料,一种合成路线如图:
 ;
;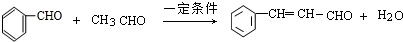 .
.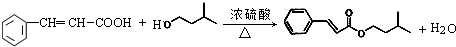 ,反应类型为酯化反应或取代反应.
,反应类型为酯化反应或取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
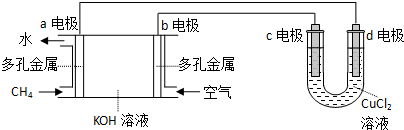
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com