
| A、双氧水 | B、食盐 |
| C、柠檬酸 | D、苯甲酸钠 |
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
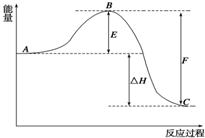 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-98.32kJ?mol-1
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-98.32kJ?mol-1查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、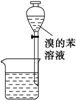 装置①为放出萃取溴水后的苯层 |
B、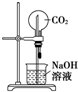 装置②为喷泉实验 |
C、 装置③不能用来吸收HCl气体 |
D、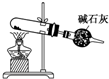 以NH4Cl为原料,装置④可用于制备少量NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大反应物浓度,可增大单位体积内活化分子数,从而使反应速率增大 |
| B、有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加单位体积内活化分子数,从而使反应速率增大 |
| C、升高温度能使化学反应速率增大的主要原因是增加了反应物的活化分子百分数 |
| D、活化分子间所发生的碰撞为有效碰撞 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、431 kJ |
| B、945.6 kJ |
| C、649 kJ |
| D、869 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
| A、向氯水中加入NaHCO3溶液,可以增大氯水中次氯酸的浓度 |
| B、四种溶液中,水的电离程度最大的是NaClO |
| C、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3溶液 |
| D、NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com