
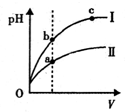
| A. | 将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,K(HF)保持不变 | |
| B. | 等物质的量浓度的 NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生 | |
| D. | 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示.II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b |
分析 A.电离常数只与温度有关;
B.等物质的量浓度的 NH4HSO4溶液和NaOH溶液等体积混合生成等浓度的硫酸铵和硫酸钠;
C.相同温度、浓度下,酸的电离平衡常数越大,酸的酸性越强,其酸根离子的水解能力越小,结合强酸制取弱酸分析解答;
D.醋酸为弱酸,存在电离平衡,当加水稀释时,氢离子浓度减小较慢,以此判断醋酸稀释时,pH的变化曲线;氢离子浓度越大,对水的电离的抑制程度越大.
解答 解:A.电离常数只与温度有关,将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,K(HF)保持不变,故A正确;
B.等物质的量浓度的 NH4HSO4溶液和NaOH溶液等体积混合生成等浓度的硫酸铵和硫酸钠,铵根离子水解溶液显酸性,则c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故B正确;
C.酸性H2CO3>HCN>HCO3-,所以氢氰酸加入到碳酸钠溶液中,没有气体生成,故C错误;
D.醋酸为弱酸,存在电离平衡,当加水稀释时,氢离子浓度减小较慢,所以醋酸稀释时,pH增大较慢,曲线Ⅱ为醋酸的pH值变化;氢离子浓度越大,对水的电离的抑制程度越大,且a中溶液的pH小,即氢离子浓度大,所以a点水的电离程度小,则a、b两点水的电离程度:a<b,故D正确;
故选C.
点评 本题考查了弱电解质的电离,明确酸的电离平衡常数与酸性强弱、酸根离子水解能力的关系是解本题关键,难度中等.


科目:高中化学 来源: 题型:选择题
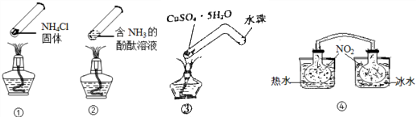
| A. | 加热时,①上部汇集了固体NH4Cl,说明NH4Cl易升华 | |
| B. | 加热时,②溶液颜色变,冷却后又恢复为原来的颜色 | |
| C. | 加热时,③中固体由蓝色变为白色,冷却后又恢复为原来的颜色 | |
| D. | ④中,浸泡在热水中的容器内气体颜色变深,说明受热时反应2NO2?N2O4向正方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中含有0.6NA个K+ | |
| B. | 1L溶液中含有K+和SO42-总数为0.9NA | |
| C. | 取出10mL该溶液中,K+浓度为0.3mol/L | |
| D. | 100mL溶液中含有SO42-数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH2O含有的氢原子数目为NA | |
| B. | 标准状况下,22.4LCO2含有的分子数目为NA | |
| C. | 常温常压下,1.06gNaCO3含有的分子数目为0.02NA | |
| D. | 1L1mol/L的KClO3溶液中含有的Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据u,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据u,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制备氢气 | |
| B. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 | |
| C. | 灼热的木炭与CO2的反应 | |
| D. | 铝粉与氧化铁粉末反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO32- | NO3- | Cl- |
| 浓度/mol•L-1 | 7×10-6 | 3×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |


| 时间(min) 浓度(mol/L-1) | 0min | 10min | 20min | 30min | 40min | 50min |
| NO(mol/L-1) | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2(mol/L-1) | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2(mol/L-1) | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 某有机物与溴的四氯化碳溶液混合 | 溶液褪色 | 有机物含碳碳双键 |
| B | 乙醇与重铬酸钾(K2Cr2O7)溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 常温下,将二氧化碳通入苯酚钠溶液 | 溶液变浑浊 | 酸性:碳酸>苯酚 |
| D | 苯和苯酚稀溶液分别与浓溴水混合 | 后者产生白色沉淀 | 羟基影响了苯环的活性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com