
| Y | ||||
| Q | W | X | Z |
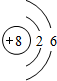 ����һ��˵��Z�ķǽ����Ա�X�ķǽ�����ǿ����ʵ������ǿ����HClO4��H3PO4�����ȶ��ԣ�HCl��PH3��
����һ��˵��Z�ķǽ����Ա�X�ķǽ�����ǿ����ʵ������ǿ����HClO4��H3PO4�����ȶ��ԣ�HCl��PH3��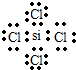 ��
������ �ɶ�����Ԫ�ص����λ�ã���֪Y���ڵڶ����ڣ��������ڵ������ڣ���W�ĵ�����һ����Ҫ�뵼����ϣ���WΪSiԪ�أ�����֪QΪAl��XΪP��YΪO��ZΪCl��
��1�����ݺ�������Ų����ɻ���ԭ�ӽṹʾ��ͼ�����Ը�����ۺ����������ǿ�����⻯���ȶ��ԵȽ����жϣ�
��2��ͬ����������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶����W��Z�γɵĻ�����ΪSiCl4��Siԭ����Clԭ��֮���γ�1�Թ��õ��Ӷԣ�
��3������������FeBr2��Ϊ1mol����ԭ��Fe2+��Br-������������Fe2+ΪFe3+�����ݵ���ת���غ㣬1molFe2+����0.5mol��������ʣ���0.5mol������������1molBr-��
��4�����ݸ�˹���ɣ��ɵã�Na2O��s��+$\frac{1}{2}$O2��g��=Na2O2��s����H=-97 kJ/mol������H-T��S��0ʱ����Ӧ���Է����У�
��0.2mol Na2O2���뵽100mL1mol/L AlCl3�У�AlCl3Ϊ0.1mol������������ˮ��Ӧ����0.4molNaOH���Ȼ�������������ǡ�÷�Ӧ����NaAlO2��
��5��Ksp[R��OH��2]=c��R2+����c2��OH-��=4.0��l0-12����������Һ��c��R2+��=$\frac{1}{2}$c��OH-�����������㱥����Һ��c��OH-����
��� �⣺�ɶ�����Ԫ�ص����λ�ã���֪Y���ڵڶ����ڣ��������ڵ������ڣ���W�ĵ�����һ����Ҫ�뵼����ϣ���WΪSiԪ�أ�����֪QΪAl��XΪP��YΪO��ZΪCl��
��1��YΪOԪ�أ�ԭ�ӽṹʾ��ͼΪ��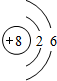 ������ǿ����HClO4��H3PO4�����ȶ��ԣ�HCl��PH3�ȶ�����˵��Cl�ķǽ����Ա�P��ǿ��
������ǿ����HClO4��H3PO4�����ȶ��ԣ�HCl��PH3�ȶ�����˵��Cl�ķǽ����Ա�P��ǿ��
�ʴ�Ϊ��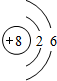 ������ǿ����HClO4��H3PO4�����ȶ��ԣ�HCl��PH3��
������ǿ����HClO4��H3PO4�����ȶ��ԣ�HCl��PH3��
��2��ͬ����������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶����ԭ�Ӱ뾶��r��Si����r��P����r��O����W��Z�γɵĻ�����ΪSiCl4��Siԭ����Clԭ��֮���γ�1�Թ��õ��Ӷԣ�����ʽΪ�� ��
��
�ʴ�Ϊ��r��Si����r��P����r��O���� ��
��
��3������������FeBr2��Ϊ1mol����ԭ��Fe2+��Br-������������Fe2+ΪFe3+�����ݵ���ת���غ㣬1molFe2+����0.5mol��������ʣ���0.5mol������������1molBr-����Ӧ���ӷ���ʽΪ��2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-��
�ʴ�Ϊ��2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-��
��4����֪���٣�2Na��s��+$\frac{1}{2}$O2��g��=Na2O��s����H=-414kJ/mol��
�ڣ�2Na��s��+O2��g���TNa2O2��s����H=-511kJ/mol
���ݸ�˹���ɣ���-�ٿɵã�Na2O��s��+$\frac{1}{2}$O2��g��=Na2O2��s����H=-97 kJ/mol���÷�Ӧ��S��0������H-T��S��0ʱ����Ӧ���Է����У��ʵ����¿����Է����У�
��0.2mol Na2O2���뵽100mL1mol/L AlCl3�У�AlCl3Ϊ0.1mol������������ˮ��Ӧ����0.4molNaOH���Ȼ�������������ǡ�÷�Ӧ����NaAlO2���ʷ�Ӧ����ʽΪ��2Na2O2+AlCl3=NaAlO2+3NaCl+O2����
�ʴ�Ϊ��Na2O��s��+$\frac{1}{2}$O2��g��=Na2O2��s����H=-97 kJ/mol������S��0����H-T��S�ڵ�����С��0�����Է����У�2Na2O2+AlCl3=NaAlO2+3NaCl+O2����
��5��Ksp[R��OH��2]=c��R2+����c2��OH-��=4.0��l0-12����������Һ��c��R2+��=$\frac{1}{2}$c��OH-���������ɵñ�����Һ��c��OH-��=2.0��l0-4 mol/L��
�ʴ�Ϊ��2.0��l0-4��
���� ������Ԫ���ƶ�Ϊ���壬����Ԫ�������ɡ�����ʽ������ʽ��д���Ȼ�ѧ����ʽ����Ӧ�Է��ԡ��ܶȻ��йؼ��㣬�ǶԻ���֪ʶ���ۺϿ��飬��Ҫѧ���߱���ʵ�Ļ������Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ӵİ뾶��Y��X | |
| B�� | �⻯����ȶ��ԣ�Z��W | |
| C�� | X��Z�γɵĻ���������ˮ������Һ�Լ��� | |
| D�� | Y��W�γɵĻ���������ˮ������Һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
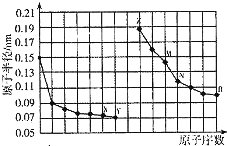
| A�� | NX2һ�������ᷴӦ | |
| B�� | R2��ˮ��Ӧʱ��ˮ�ǻ�ԭ�� | |
| C�� | �����ӵİ뾶��M��Z��X | |
| D�� | ����������Ӧˮ����ļ��ԣ�Z��M |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | X���⻯��ķе���ܸ���Y���⻯��ķе� | |
| B�� | ԭ�Ӱ뾶�Ƚϣ�X��Y��Z��W | |
| C�� | X2H4��H2W����ʹ��ˮ��ɫ������ɫԭ����ͬ | |
| D�� | ����������Ԫ���У�Z������������ˮ���������ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1L 0.1 mol•L-1Na2CO3��Һ�к���0.1NACO32- | |
| B�� | 4.2gN3-�к��еĵ�����Ϊ2.4NA | |
| C�� | 6.4gCu������Ũ���ᷴӦ��һ��ת��0.2 NA������ | |
| D�� | ���³�ѹ�£�22.4L H2O�й��õ��Ӷ���Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ����������� | ���� |
| A | �ò�˿պȡij����Һ�ھƾ������������գ��������ɫ������ɫ�ܲ����� | ������Һ�п��ܺ���Ԫ�� |
| B | ��ij��ɫ��Һ��ͨ�˹�����CO2���壬�а�ɫ�������� | ����Һ��һ������SiO32- |
| C | ��Ʒ����Һ��ͨ��ij�������Һ��ɫ | ������һ����SO2 |
| D | ��NaOH��Һ�еμ�����MgCl2��Һ��������ɫ�����������μ�FeCl3��Һ�������ɫ���� | Fe��OH��3���ܽ��С��Mg��OH��2���ܽ�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ�� | ���ͻ���� |
| A | �ýྻ��Ptպȡij��Һ������ɫ��Ӧ������ʻ�ɫ | ����Һ��һ������Na+����k+ |
| B | �ýྻ�IJ����������Na2O2����֬��������֬��ȼ�� | CO2��H2O��Na2O2��Ӧ�Ƿ��ȷ�Ӧ |
| C | ����ˮ�е���ֲ���ͣ����Ͳ�����ɫ | �岻������֬ |
| D | �������ữ��H2O2����Fe��NO3��2��Һ����Һ���ɫ | H2O2�������Ա�Fe3+ǿ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com