
| A. | 2.8g铁粉在1.12L(标准状态)氯气中充分燃烧,失去的电子数为0.15NA | |
| B. | 常温下,0.1mol/LHCl溶液中所含的H+个数为0.1NA | |
| C. | 11.2L 的CO气体与0.5molN2所含的电子数相等 | |
| D. | 10gH218O中所含的中子数为5NA |
分析 A.铁与氯气反应生成氯化铁,1mol铁完全反应消耗1.5mol氯气,显然氯气不足,转移的电子数应该按照氯气的量进行计算;
B.溶液体积未知;
C.气体状况未知,摩尔体积不确定;
D.1个1H218O的中子数为10.
解答 解:A.2.8g铁粉在1.12L(标准状态)氯气中充分燃烧,氯气不足,应依据氯气的物质的量计算转移电子数,反应失去的电子数为0.1NA,故A错误;
B.溶液体积未知,无法计算,故B 错误;
C.气体状况未知,摩尔体积不确定,无法计算CO的物质的量,故C错误;
D.10gH218O的物质的量为$\frac{10g}{20g/mol}$=0.5mol,含的中子数为5NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的判断及计算,题目难度中等,注意明确标况下气体摩尔体积的使用条件,熟练掌握物质的量与阿伏伽德罗常数等物理量之间的转化关系,题目难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
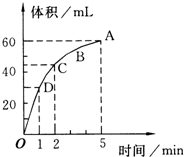 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中,在标准状况下放出气体的体积和时间的关系如图所示(5分钟反应完成),回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中,在标准状况下放出气体的体积和时间的关系如图所示(5分钟反应完成),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅在电子工业中,是最重要的半导体材料 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 | |
| C. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| D. | 光导纤维是以二氧化硅为主要原料制成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸跟氢氧化钠溶液反应:CH3COOH+OH-→CH3COO-+H2O | |
| B. | 铁跟稀盐酸反应:Fe+2H+→Fe2++H2↑ | |
| C. | 在硫氢化钠溶液中加入稀硫酸溶液:S2-+2H+→H2S↑ | |
| D. | 碳酸钙溶于盐酸中:CaCO3+2H+→Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 CO气体还原FeO固体可以得到Fe固体,铁的化合物具有重要的应用.
CO气体还原FeO固体可以得到Fe固体,铁的化合物具有重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏水洗净滴定管后,装入标准盐酸进行滴定 | |
| B. | 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,而后装入一定体积的NaOH溶液 | |
| C. | 用酚酞作指示剂时,滴至溶液从红色变成无色即视为滴定终点 | |
| D. | 用碱式滴定管取10.00mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+ K+ MnO4- Cl- | B. | Na+ H+ NO3- SO42- | ||
| C. | K+ Ca2+ NO3- CO32- | D. | Cu2+ Na+ Cl- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 | |
| B. | 在铁上镀锌时,锌棒作阳极,且电解液硫酸锌的浓度是不变的 | |
| C. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| D. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com