
科目:高中化学 来源: 题型:
已知X、Y、Z、W(含同一元素)有如下所示转化关系,且X能与W发生反应生成一种易溶于水的盐,则X可能是( )
X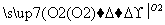 Y
Y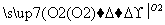 Z
Z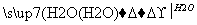 W
W
A.N2 B.NO2
C.NH3 D.NO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 物质的化学变化都伴随着能量变化 |
|
| B. | 凡是吸热反应都需要加热 |
|
| C. | 表示中和热的热化学方程式:NaOH+HCl═NaCl+H2O △H=﹣57.3 kJ•mol﹣1 |
|
| D. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)⇌2SO3(g)△H =-197kJ/mol.实验测得起始、平衡时的有关数据如下表:
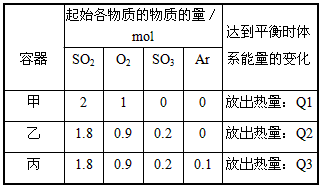
下列叙述正确的是( )
|
| A. | Q1=Q2=Q3 |
|
| B. | 达到平衡时,丙容器中SO2的体积分数最大 |
|
| C. | 甲、乙、丙3个容器中反应的平衡常数不相等 |
|
| D. | 若在上述条件下反应生成2molSO3(s)的放热大于197kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:
(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L)中,在一定条件下发生反应:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)(Ⅰ)
达平衡时,CH4的转化率与温度、压强的关系如图1所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 .
②该反应的△H 0,△S 0(填“<”、“>”或“=”).
(2)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:
CO(g)+2H2(g)⇌ CH3OH(g) △H<0 (Ⅱ)
①若容器的容积不变,下列措施可增大甲醇产率的是 (填序号).
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大
D.再充入a mol CO和3a mol H2
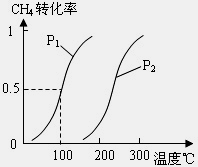
图1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及其结论都正确的是( )。
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的酸性比H2SO4强 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
类推思维是化学解 题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
| B | 向稀硫酸加入NaOH溶液至中性 H++OH-=H2O | 向H2SO4溶液加入Ba(OH)2溶液至中性 H++OH-=H2O |
| C | 向氯化铝溶液中加入足量NaOH溶液 Al3+ + 4OH- = AlO2- + 2H2O | 向氯化铝溶液中加入足量氨水 Al3+ + 4NH3·H2O = AlO2- + 2H2O +4NH4+ |
| D | 向Ca(OH)2溶液中通入过量 CO2 | 向Ca(OH)2溶液中通入过量SO2 SO2 + OH- = HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA 表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4LCH2Cl2中含C-Cl键数目为0.2NA
B.常温常压下,10g92%酒精水溶液含氧原子总数为0.2NA
C.常温常压下,0.1molNa2O2与水完全反应转移电子数为0.2NA
D.常温常压下,3.0g尿素与乙酸的混合物,含氢原子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨工业对化学和国防工业具有重要意义。
(1)实验室欲用如图所示装置(夹持固定装置略去)制备并收集氨气。
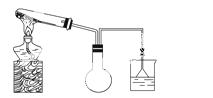
①请在图中烧瓶内绘出导 管所缺部分。
管所缺部分。
②试管中发生反应的化学方程式是____________。
③为吸收多余的氨气,烧杯中的试剂是________。
(2)氨有很多重要性质。
①将酚酞溶液滴加到氨水中溶液呈红色,其原因是_________
_____________________________________________________。
②管道工人曾经用浓氨水检验氯气管道是否泄漏,如出现白烟,说明有氯气泄漏,同时还有一种相对分子质量为28的气体生成,该反应的化学方程式是________。
(3)写出氨的两种用途:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com