
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 5 | C. | 6 | D. | 10000 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CBr2F2 | B. | CH3CH2OH | C. | CH3CH2CH3 | D. | CH3CH(OH)COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
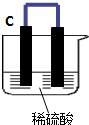 如图所示,将锌、铜通过导线相连置于稀硫酸中.
如图所示,将锌、铜通过导线相连置于稀硫酸中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
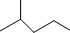 表示的分子式C6H14结构简式CH3CH(CH3)CH2CH2CH3名称是2-甲基戊烷.
表示的分子式C6H14结构简式CH3CH(CH3)CH2CH2CH3名称是2-甲基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ③④ | C. | ②④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验示意图 | 实验现象 | 解释 |
甲: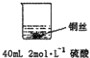 | 无明显现象 | 稀硫酸只能表现酸的氧化性,而铜排在金属活动顺序表氢之后,不能将氢置换出来. |
乙: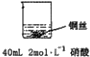 | 铜丝逐渐溶解,铜丝表面有气泡产生,溶液颜色变蓝 | 稀硝酸是氧化性的酸,能与铜发生反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
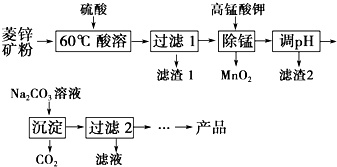 以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:
以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ |
| 开始沉淀时pH | 5.8 | 1.1 | 5.9 |
| 完全沉淀时pH | 8.8 | 3.2 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com