
| 元素符号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与L形成的最高价氧化物对应水化物的碱性:L>M | |
| C. | 氢化物的稳定性为H2T<H2R | |
| D. | 单质与等浓度的稀盐酸反应的速率为Q>L |
分析 短周期元素,T、R都有-2价,处于ⅥA族,T只有-2价,则T为O元素、R为S元素,L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg元素、Q为Be元素,M有+3价,处于ⅢA族,原子半径M的介于L、R之间,则M为Al元素,以此解答该题.
解答 解:短周期元素,T、R都有-2价,处于ⅥA族,T只有-2价,则T为O元素、R为S元素,L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg元素、Q为Be元素,M有+3价,处于ⅢA族,原子半径M的介于L、R之间,则M为Al元素.
A.L2+的核外电子数为12-2=10,R2-的核外电子数为16-(-2)=18,核外电子数不相等,故A错误;
B.L为Mg元素,M为Al元素,金属性Mg>Al,元素的金属性越强,对应的最高价氧化物对应水化物的碱性越强,故B正确;
C.非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,故C错误;
D.金属性Mg>Be,则Mg与酸反应越剧烈,故D错误.
故选B.
点评 本题考查结构性质位置关系应用,关键是根据原子半径及化合价来推断元素,注意对元素周期律的理解,熟悉元素及其单质、化合物的性质.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:多选题
| A. | 稀盐酸与铁粉反应:Fe+2H+=Fe2++H2↑ | |
| B. | 碳酸钡溶于醋酸:BaCO3+2H+=Ba2++H2O+CO2↑ | |
| C. | 锌片插入硝酸银溶液中:Zn+2Ag+=Zn2++2Ag | |
| D. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
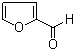 呋喃甲醛(即糠醛)的结构简式如图,其分子中的环和苯环有相似的化学性质(即有“芳香性”),则关于糠醛的叙述错误的是( )
呋喃甲醛(即糠醛)的结构简式如图,其分子中的环和苯环有相似的化学性质(即有“芳香性”),则关于糠醛的叙述错误的是( )| A. | 能生成呋喃甲醇 | B. | 能生成呋喃甲酸 | ||
| C. | 能与溴水生成多种加成产物 | D. | 能与苯酚制备糠醛树脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 反应前质量/g | 反应后质量/g | |
| U型管+固体 | a | b |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeCl3与沸水反应生成的胶体中含有NA个Fe(OH)3胶粒 | |
| B. | 1.12LNH3所含的原子数是0.2NA | |
| C. | 常温常压下,0.4molNa2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA | |
| D. | 1molNa2O2晶体中共含有4NA个离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑧ | B. | ③④⑥⑦ | C. | ①③⑦⑧ | D. | ②④⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com