
将0.2mol•L﹣1 HCN溶液和0.1mol•L﹣1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
( )
|
| A. | c(HCN)<c(CN﹣) | B. | c(Na+)<(CN﹣) |
|
| C. | c(HCN)﹣c(CN﹣)=c(OH﹣) | D. | c(HCN)+c(CN﹣)=0.1mol•L﹣1 |
考点:
酸碱混合时的定性判断及有关ph的计算.
专题:
电离平衡与溶液的pH专题.
分析:
将0.2 mol•L﹣1 HCN溶液和0.1 mol•L﹣1的NaOH溶液等体积混合后,所得溶液中c(HCN)=0.05 mol•L﹣1,c(NaCN)=0.05 mol•L﹣1,由于混合后溶液呈碱性,说明NaCN水解程度大于HCN的电离程度,结合电荷守恒和物料守恒解答该题.
解答:
解:将0.2 mol•L﹣1 HCN溶液和0.1 mol•L﹣1的NaOH溶液等体积混合后,由于混合后溶液呈碱性,说明NaCN水解程度大于HCN的电离程度,
A.NaCN水解程度大于HCN的电离程度,则c(HCN)>c(CN﹣),故A错误;
B.由上述分析知c(CN﹣)<0.05 mol•L﹣1,而c(Na+)=0.05 mol•L﹣1,故B错误;
C.根据物料守恒可知c(HCN)+c(CN﹣)=2c(Na+),又据电荷守恒可知c(H+)+c(Na+)=c(CN﹣)+c(OH﹣),则2c(H+)+c(HCN)+c(CN﹣)=2c(CN﹣)+2c(OH﹣),则有c(HCN)﹣c(CN﹣)=2c(OH﹣)﹣2c(H+),故C错误;
D.根据C、N元素守恒可知c(HCN)+c(CN﹣)=0.1 mol•L﹣1,故D正确.
故选D.
点评:
本题考查酸碱混合的定性判断,为高考常见题型,综合考查学生的分析能力,题目难度中等,注意溶液电荷守恒和物料守恒的运用.


科目:高中化学 来源: 题型:
室温下,某溶液中由水电离出的c(OH﹣)=10﹣5 mol•L﹣1,则其溶质可能是( )
|
| A. | CH3COOH | B. | H2SO4 | C. | NaOH | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,甲池的总反应式O2+N2H4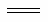 2H2O+N2。有关该装置工作时,说法正确的是
2H2O+N2。有关该装置工作时,说法正确的是
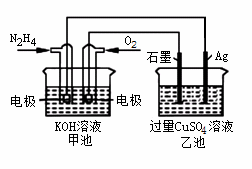
A.甲池中,负极反应为N2H4-4e-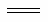 4H++N2
4H++N2
B.甲池溶液pH保持不变,乙池溶液pH减小
C.甲池中消耗2.24LO2,此时乙池中理论上最多产生12.8g固体
D.反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是
A.反应中硫元素被氧化,所有铁元素均被还原
B.氧化剂是Fe3+,氧化产物是Cu2+
C.反应中转移电子的物质的量为x mol
D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源。
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如图-1所示:
①a反应中每生成1molFeSO4转移电子的物质的量为 mol。
②d反应的离子方程式为 。
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如图-2。
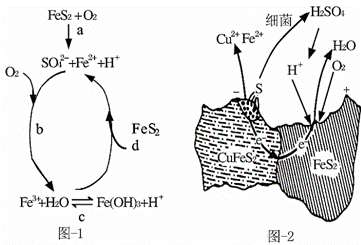
①冶炼过程中,正极周围溶液的pH (填“增大”、“减小”或“不变”)。
②负极产生单质硫的电极反应式为 。
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数的对数值与温度的关系如图-3。
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s) + H2(g) | ΔH1 | K1 |
| 1/2 FeS2(s) + H2(g) | ΔH2 | K2 |
| FeS(s) + H2(g) | ΔH3 | K3 |
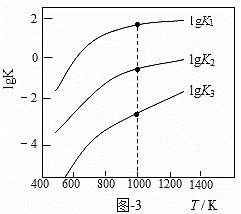
①上述反应中,ΔH1 0(填“>”或“<”)。
②提高硫的脱除率可采取的措施有 (举1例)。
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有关溶液(均在常温下)的结论正确的是( )
|
| A. | pH=1的盐酸与pH=5的盐酸等体积混合后pH=3 |
|
| B. | 0.1mol/L醋酸溶液100 mL与0.2 mol/L氨水50 mL混合后能恰好完全中和 |
|
| C. | pH>7的溶液中不可能存在CH3COOH分子 |
|
| D. | 等浓度等体积的KOH溶液和CH3COOH溶液混合后:c(CH3COO﹣)=c(K+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶掖等体积混合后,下列关系式中正确的是( )
|
| A. | c(Na+)=c(CH3COO﹣)+c(CH3COOH) | B. | c(H+)=c(CH3COO﹣)+c(OH﹣) |
|
| C. | c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+) | D. | c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣) |
查看答案和解析>>
科目:高中化学 来源: 题型:
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图所示,回答下列问题:
(1)若a=5,则A为 酸,B为 酸(填“强”、或“弱”),若再稀释100倍,则A的pH 7(填“<”、“>”或“=”).
(2)若A、B都是弱酸,则a的范围是 .

查看答案和解析>>
科目:高中化学 来源: 题型:
已知苯跟一卤代烷在催化剂作用下,可生成苯的同系物.
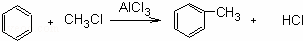
如在催化剂作用下,苯和下列各组物质合成乙苯最好应选用的是( )
|
| A. | CH3CH3和Cl2 | B. | CH2=CH2和Cl2 | C. | CH2=CH2和HCl | D. | CH≡CH和Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com