
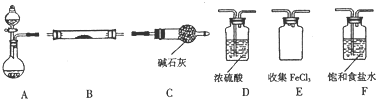
 .
.分析 (1)在导管上连接橡胶导管和弯导管,旋紧胶塞,关闭分液漏斗活塞,将导管一端浸入水中,用双手捂住锥形瓶,若导管口冒出气泡,则气密性好或在导管上连接橡胶导管,夹上止水夹,旋紧胶塞,向分液漏斗中加水,打开活塞,水滴了一会儿不再流下,则气密性好;
(2)利用装置制备氯化铁,FeCl3遇水蒸气会产生白雾,制得氯化铁不能接触到水蒸气,圆底烧瓶中盛装KMnO4,分液漏斗中盛装浓盐酸制备氯气,氯气中含有水蒸气和氯化氢,需要通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,得到干燥的氯气和铁加热反应生成氯化铁,FeCl3的熔点为306℃,沸点为315℃,氯化铁蒸气在装置E中冷却收集,最后装置连接干燥管C目的是防止空气中的水蒸气进入装置E;
(3)上述分析可知,连接干燥管C目的是防止空气中的水蒸气进入装置E与氯化铁反应;
(4)依据元素化合价变化结合电子守恒计算得到锰元素化合价;
(5)A装置中发生反应为高锰酸钾和浓盐酸反应生成氯化锰,氯化钾,氯气和水,结合电子守恒配平书写,标注电子得失数;
(6)利用亚铁离子具有还原性,遇到氧化剂高锰酸钾溶液发生氧化还原反应,使溶液褪色设计实验检验.
解答 解:(1)装置气密性检查是利用装置内压强变化引起液面的变化设计方向,A连接导气管,将导气管放入水中,关闭分液漏斗活塞,微热圆底烧瓶或用热毛巾捂住容器,观察水中的导气管口是否有气泡冒出,如有气泡冒出,停止微热或拿走热毛巾,导气管内有一段水柱,说明气密性良好,
故答案为:A连接导气管,将导气管放入水中,关闭分液漏斗活塞,微热圆底烧瓶或用热毛巾捂住容器,观察水中的导气管口是否有气泡冒出,如有气泡冒出,停止微热或拿走热毛巾,导气管内有一段水柱,说明气密性良好;
(2)利用装置制备氯化铁,FeCl3遇水蒸气会产生白雾,制得氯化铁不能接触到水蒸气,圆底烧瓶中盛装KMnO4,分液漏斗中盛装浓盐酸制备氯气,氯气中含有水蒸气和氯化氢,需要通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,得到干燥的氯气和铁加热反应生成氯化铁,FeCl3的熔点为306℃,沸点为315℃,氯化铁蒸气在装置E中冷却收集,最后这张连接干燥管防止空气中的水蒸气进入装置E,装置连接顺序为:A-F-D-B-E-C,
故答案为:F;D;B;E;C;
(3)FeCl3遇水蒸气会产生白雾,装置E不能进入空气,连接干燥管C目的是防止空气中的水蒸气进入装置E与氯化铁反应,同时吸收过量的氯气,防止污染空气,
故答案为:防止空气中的水蒸气进入装置E与氯化铁反应,吸收剩余Cl2防止污染空气;
(4)用0.2mol的高锰酸钾固体和足量的浓盐酸完全反应后,得到标准状况下氯气的体积为11.2L,折锰元素化合价变化为x,
0.2mol×(7-x)=$\frac{11.2L}{22.4L/mol}$×2
得到x=2,
故答案为:+2;
(5)KMnO4反应,锰元素化合价+7价变化为+2价,氯元素化合价-1价变化为0价,结合电子守恒配平书写化学方程式为16HCl+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O,电子转移10,则双线桥标注的氧化还原反应电子转移方程式为: ,
,
故答案为: ;
;
(6)利用亚铁离子具有还原性,遇到氧化剂高锰酸钾溶液发生氧化还原反应,使溶液褪色设计实验检验,取少量FeCl3固体溶于水,滴加酸性KMnO4溶液,如果KMnO4溶液褪色,说明含有FeCl2,如果KMnO4溶液不褪色,说明不含FeCl2,
故答案为:取少量FeCl3固体溶于水,滴加酸性KMnO4溶液,如果KMnO4溶液褪色,说明含有FeCl2,如果KMnO4溶液不褪色,说明不含FeCl2.
点评 本题考查了物质性质和氧化还原反应分析,实验设计方法,装置连接顺序和原则,注意知识积累,掌握基础是关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
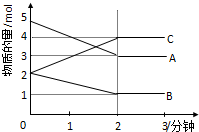 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用25mL量筒量取12.36mL盐酸 | |
| B. | 用托盘天平称量8.75g食盐 | |
| C. | 用广泛pH试纸测得某溶液的pH为3.5 | |
| D. | 配制240mL溶液选用250mL的容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  装置:除去Cl2中的HCl杂质 装置:除去Cl2中的HCl杂质 | |
| B. | 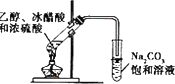 装置:制取乙酸乙酯 装置:制取乙酸乙酯 | |
| C. | 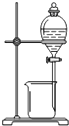 装置:用酒精萃取碘水中的碘单质 装置:用酒精萃取碘水中的碘单质 | |
| D. |  烧瓶中充满氨气,烧杯中盛装四氯化碳,可产生喷泉现象 烧瓶中充满氨气,烧杯中盛装四氯化碳,可产生喷泉现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是制造太阳能电池的常用材料 | B. | 二氧化硅是制造光导纤维的材料 | ||
| C. | 水玻璃可用作木材防火剂 | D. | 二氧化硅可以做砂纸、砂轮的磨料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com