
| A. | 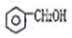 醇类-OH 醇类-OH | B. | CH3CH2COOH 羧酸类-COOH | ||
| C. | 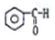 酮类-CHO 酮类-CHO | D. | CH3CH2Br 卤代烃类-Br |
科目:高中化学 来源: 题型:实验题
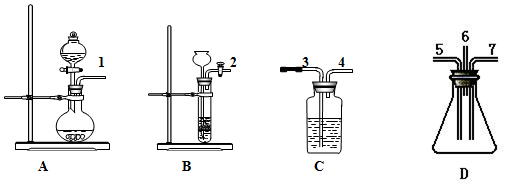
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-l•s-l | B. | 0.4 mol•L-l•s-l | C. | 0.6 mol•L-l•s-l | D. | 0.8 mol•L-l•s-l |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁红的主要成分是Fe3O4 | |
| B. | 铁与水蒸气在高温下的反应产物为Fe2O3和H2 | |
| C. | 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 | |
| D. | Fe3+与KSCN产生红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸有脱水性,故可用做干燥剂 | |
| B. | 浓硫酸有强酸性,故能与金属活动顺序氢后的金属反应 | |
| C. | 硫酸的酸性比盐酸强,利用复分解反应用硫酸可以制盐酸 | |
| D. | 由于浓硫酸具强氧化性,因此不能干燥硫化氢和碘化氢气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生物质能源是可再生的能源 | |
| B. | 生物质能来源于太阳能 | |
| C. | 使用沼气作为能源是利用生物质能的一种方式 | |
| D. | 生物质能的缺点是严重污染环境 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com