
| A. | m=-26.5 2c=a-b | B. | m=-53 c2=$\frac{a}{b}$ | C. | m=-26.5 c2=$\frac{a}{b}$ | D. | m=-53 2c=a-b |
分析 由(1)2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ/mol K1=a
(2)2NO(g)+O2(g)?2NO2(g)△H2=-144kJ/mol K2=b
结合盖斯定律可知,[(1)-(2)]×$\frac{1}{2}$得到(3)NO2(g)+SO2(g)?SO3(g)+NO(g),以此来解答.
解答 解:由(1)2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ/mol K1=a
(2)2NO(g)+O2(g)?2NO2(g)△H2=-144kJ/mol K2=b
结合盖斯定律可知,[(1)-(2)]×$\frac{1}{2}$得到(3)NO2(g)+SO2(g)?SO3(g)+NO(g),
则△H3=(-197kJ/mol+144kJ/mol)×$\frac{1}{2}$=-26.5kJ/mol,
c=$\sqrt{\frac{a}{b}}$,即c2=$\frac{a}{b}$,
故选C.
点评 本题考查化学平衡常数及焓变,为高频考点,把握盖斯定律、K及焓变的关系为解答的关键,侧重分析与应用能力的考查,注意K为指数关系,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
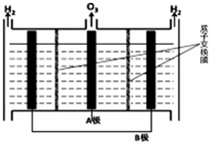 NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,请根据题意回答下列问题:
NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,请根据题意回答下列问题:| 时间(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L水中含有的分子数约为0.l NA | |
| B. | 在常温常压下,1 mol He含有的原子数为NA | |
| C. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| D. | 物质的量浓度为0.5mol/L FeCl3溶液中Cl-的数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| H2 | SO2 | H2 | SO2 | ||
| 容器Ⅰ | 300 | 0.3 | 0.1 | 0.02 | |
| 容器Ⅱ | 300 | 0.6 | 0.2 | ||
| 容器Ⅲ | 240 | 0.3 | 0.1 | 0.01 | |
| A. | 该反应正反应为吸热反应 | |
| B. | 容器Ⅲ达到平衡的时间比容器I短 | |
| C. | 240℃时,该反应的平衡常数为1.08×104 | |
| D. | 容器Ⅱ达到平衡时SO2的转化率比容器I小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molN2与3 mol H2反应生成的NH3分子数为2NA | |
| B. | 2.4g镁在足量的氧气中燃烧,转移的电子数为0.1NA | |
| C. | 标准状况下,2.24L的CCl4中含有的C-Cl键数为0.4NA | |
| D. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 制备氨气 | 将浓氨水逐滴滴入CaO固体中 |
| B | 制备氯气 | 将浓盐酸逐滴滴入浓硫酸 |
| C | 制备氧气 | 向双氧水中滴入ZnSO4溶液 |
| D | 制备氢气 | 酒精灯加热碳与水的混合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | |
| B. | 混合气体的密度 | |
| C. | 气体的总物质的量 | |
| D. | 单位时间内生成nmolC的同时消耗2nmolB |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com