
 四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.
四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.| X | Y | |
| Z | W |
 ;W最高价氧化物的水化物的化学式:HClO4.
;W最高价氧化物的水化物的化学式:HClO4.分析 X、Y、Z、W均为短周期元素,由位置关系可知,X、Y处于第二周期,Z、W处于第三周期,Z元素最外层电子数是其电子层数的2倍,最外层电子数为6,则Z为S元素,故X为N元素、Y为O元素、W为Cl元素;元素M与S同周期,且原子半径是同周期中最大,所以M为Na;元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙,则甲为Fe(OH)2,乙为Fe(OH)3,所以R为Fe元素;结合元素周期律解答.
解答 解:X、Y、Z、W均为短周期元素,由位置关系可知,X、Y处于第二周期,Z、W处于第三周期,Z元素最外层电子数是其电子层数的2倍,最外层电子数为6,则Z为S元素,故X为N元素、Y为O元素、W为Cl元素;元素M与S同周期,且原子半径是同周期中最大,所以M为Na;元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙,则甲为Fe(OH)2,乙为Fe(OH)3,所以R为Fe元素;
(1)X为N元素,其单质氮气的电子式为 ;W为Cl元素,其最高价氧化物的水化物的化学式为:HClO4;
;W为Cl元素,其最高价氧化物的水化物的化学式为:HClO4;
(2)M、Z、W分别形成的简单离子分别为:Na+、S2-、Cl-,则半径由大到小顺序为S2->Cl->Na+;非金属性强的元素形成的单质能把非金属性弱的元素形成的单质从溶液中置换出来,如:H2S+Cl2=S2↓+2HCl:
故答案为:S2->Cl->Na+;H2S+Cl2=S2↓+2HCl;
(3)甲为Fe(OH)2,乙为Fe(OH)3,氢氧化铁与氧气、水反应生成氢氧化铁,其反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)常温下,当用200mL 1mol•L-1的NaOH溶液吸收4.48L(已折算为标准状况)SO2,NaOH为0.2mol,SO2为0.2mol,二者等物质的量恰好反应生成NaHSO3,即所得溶液的主要溶质(填化学式)为NaHSO3;NaHSO3溶液pH<7,HSO3-的电离程度大于水解程度,所以溶液中含S粒子的浓度关系为c(HSO3-)>c(SO32-)>c(H2SO3);
故答案为:NaHSO3;c(HSO3-)>c(SO32-)>c(H2SO3);
(5)工业上用电化学法治理酸性废液中的NO3-的原理如图示,电解时阴极上NO3-发生得电子的还原反应生成N2,则其阴极的反应式为2NO3-+12H++10e-=N2↑+6H2O;
故答案为:2NO3-+12H++10e-=N2↑+6H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语、元素周期律、元素化合物的性质和电解原理的考查,较好的考查学生运用知识分析问题、解决问题的能力,难度中等.


科目:高中化学 来源: 题型:选择题
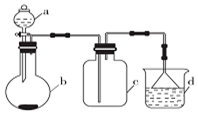 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中物质 | b中物质 | c中物质 | d中收集的气体 |
| A | 浓氨水 | CaO | NH3 | H3O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 浓硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
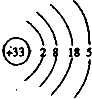 ;其氢化物的化学式为AsH3.
;其氢化物的化学式为AsH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯与乙醇的分离可用分液操作 | |
| B. | 滴定管、容量瓶、分液漏斗等仪器,在使用前均须冼净并检查是否漏水 | |
| C. | 碘酒中加CCl4振荡睁置后,上层几乎为无色,下层为紫色 | |
| D. | 蒸馏、分馏和干馏都是利用物质沸点不同而将物质分离的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米铁粉可以高效地去除被污染水体中的 Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子有较强的物理吸附 | |
| B. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| C. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| D. | 火力发电中,燃烧是使化学能转换为电能的关键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
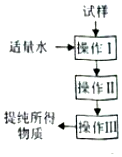 实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )
实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )| A. | 操作I一定是过滤,其目的是将固液分离 | |
| B. | 可以提纯含少量氧化铁杂质的氧化铝 | |
| C. | 可以提纯含少量氯化钠杂质的硝酸钾 | |
| D. | 可以提纯含少量碘杂质的氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{mω}{28V}$mol•L-1 | B. | $\frac{mω}{56V}$ mol•L-1 | C. | $\frac{mω}{112V}$mol•L-1 | D. | $\frac{mω}{V}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
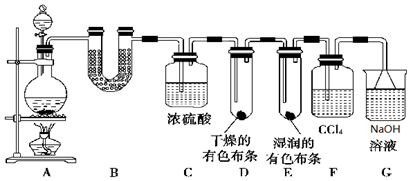
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com