
 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.分析 (1)制纯净的Fe(OH)2沉淀,则Fe为阳极,石墨为阴极,阴极上氢离子得电子;
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,电解液为CuCl2溶液,发生Fe+CuCl2=Cu+FeCl2;
(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化;加热溶液可以排除溶液中溶解的氧气;
(4)计算出氢气的物质的量,再根据电子守恒计算出生成氢氧化亚铁的物质的量及质量.
解答 解:(1)制纯净的Fe(OH)2沉淀,则Fe为阳极,石墨为阴极,阴极上氢离子得电子,则阴极发生的电极反应为2H++2e-=H2↑,
故答案为:石墨;2H++2e-=H2↑;
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,若白色沉淀在电极上生成,则电解液d是氢氧化钠;若白色沉淀在两极之间的溶液中生成,则电解液d是氯化钠溶液,但是若电解液为CuCl2溶液,发生Fe+CuCl2=Cu+FeCl2,则不会出现白色沉淀,
故答案为:C;B;
(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化;加热溶液可以排除溶液中溶解的氧气;
故答案为:隔绝空气,防止产物被氧化;赶尽溶液中的氧气;
(4)反应中生成的气体为氢气,标况下2.24L氢气的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,生成0.1mol氢气转移了0.2mol电子,根据电子守恒,则反应生成氢氧化亚铁的物质的量为:$\frac{0.2mol}{2}$=0.1mol,生成氢氧化亚铁沉淀的质量为:90g/mol×0.1mol=9g,
故答案为:9.
点评 本题考查氢氧化亚铁的制备和电解原理,题目难度中等,明确电解原理及Fe为阳极是解答本题的关键,注意实验中防止氢氧化亚铁被氧化的措施.


科目:高中化学 来源: 题型:选择题
| A. | 0.5mol O2所含氧元素数为NA | |
| B. | 0.2mol H2O所含的氢原子数为0.2NA | |
| C. | 0.1mol CH4所含电子数为NA | |
| D. | 2mol MgCl2中所含离子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
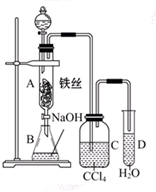 某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可发生反应生 成溴苯和溴化氢,此反应为 放热反应.他们用如图所示 装置制取溴苯.已知:溴蒸气为红棕色
某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可发生反应生 成溴苯和溴化氢,此反应为 放热反应.他们用如图所示 装置制取溴苯.已知:溴蒸气为红棕色 ,观察到A中的现象反应混合液微沸,有红棕色气体充满A容器.实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴,写出有关反应的化学方程式Br2+2NaOH═NaBr+NaBrO+H2O.
,观察到A中的现象反应混合液微沸,有红棕色气体充满A容器.实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴,写出有关反应的化学方程式Br2+2NaOH═NaBr+NaBrO+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8 | B. | C3H6 | C. | C3H4 | D. | C4H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾、漂白粉都可以用于净水,但净水原理不相同 | |
| B. | 游离态氮转化为化合态氮,只有在高温、高压和催化剂的作用下才能实现 | |
| C. | 制造光缆和计算机芯片的主要材料都含有硅元素 | |
| D. | 农业上使用高效低毒的农药,可降低蔬菜的农药残留 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H═-571.6kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H═-802.3kJ•mol-1 | |
| D. | CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com