
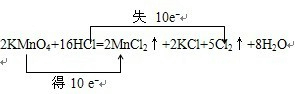

 ,故答案为:
,故答案为: .
.

 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
 一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8mol NO2,发生如下反应:2NO2(红棕色)?N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:
一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8mol NO2,发生如下反应:2NO2(红棕色)?N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:| c(N2O4) |
| c2(NO2) |
| c(N2O4) |
| c2(NO2) |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省福州文博中学高二下学期期中考试化学试卷(带解析) 题型:填空题
8分)一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:2NO2(红棕色) N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动
(填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色
(填“变深”、“变浅”或“不变”)
查看答案和解析>>
科目:高中化学 来源:2014届浙江临海市高一下学期期中考试化学卷(解析版) 题型:填空题
(每空2分,共8分)请按下列要求作答:
(1)写出将少量二氧化硫气体通入氢氧化钠溶液的化学反应方程式: ;
(2)写出将二氧化氮气体通入水中的化学反应方程式: ;
(3)写出铜与稀硝酸反应的离子方程式: ;
(4)写出氢氧化钡与稀硫酸反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2013届福建省高二下学期期中考试化学试卷(解析版) 题型:填空题
8分)一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:2NO2(红棕色)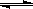 N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动
(填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色
(填“变深”、“变浅”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com