
分析 NaCN溶液和NaF溶液中都存在电荷守恒,即c(CN-)+c(OH-)=c(Na+)+c(H+),c(F-)+c(OH-)=c(Na+)+c(H+),HCN的电离程度比HF小,说明HCN的酸性比HF弱,NaCN的水解程度大,据此分析.
解答 解:HCN的电离程度比HF小,说明HCN的酸性比HF弱,NaCN的水解程度大,物质的量浓度相同的NaCN溶液比NaF溶液碱性强,c(H+)小,c(Na+)相同,所以NaCN溶液中[c(Na+)+c(H+)]小于NaF溶液中的[c(Na+)+c(H+)],据电荷守恒c(CN-)+c(OH-)=c(Na+)+c(H+),c(F-)+c(OH-)=c(Na+)+c(H+),故:[c(CN-)+c(OH-)]小于[c(F-)+c(OH-)],故答案为:小于.
点评 本题考查了电解质溶液中离子浓度大小比较,题目难度不大,注意从电解质溶液中的电荷守恒分析.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
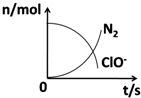 在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 还原剂是含CN-的物质,氧化产物只有N2 | |
| B. | 氧化剂是ClO-,还原产物是HCO3- | |
| C. | 配平后氧化剂与还原剂的化学计量数之比为4:1 | |
| D. | 标准状况下,若生成2.24LN2,则转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑦ | B. | ②③⑥ | C. | ②④ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键断裂时吸收能量,形成时放出能量 | |
| B. | 燃烧热是1mol可燃物完全燃烧释放的能量 | |
| C. | 中和热是稀酸与稀碱反应生成1molH2O释放的能量 | |
| D. | 燃料电池能将全部化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极反应为Fe-2e-═Fe2+ | |
| B. | 过程中有Fe(OH)3沉淀生成 | |
| C. | 电路中每转移12mol电子,最多有1molCr2O72-被还原 | |
| D. | 如果石墨做阴阳极,电解过程不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 用途 | 解释 |
| A | Al2O3 | 耐火材料 | Al2O3的熔沸点较高 |
| B | SiO2 | 计算机芯片 | SiO2是一种良好的半导体 |
| C | Fe3O4 | 红色涂料 | Fe3O4是一种红色氧化物 |
| D | 浓H2SO4 | 干燥剂 | 浓H2SO4有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com