
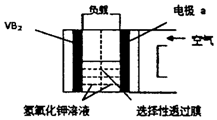
 硼化钒(VB2)-空气电池是目前储电能力最高的电池(如图所示),电池总反应为:4VB2+11O2═4B2O3+2V2O5,下列叙述错误的是( )
硼化钒(VB2)-空气电池是目前储电能力最高的电池(如图所示),电池总反应为:4VB2+11O2═4B2O3+2V2O5,下列叙述错误的是( )| A. | 负极反应式为4VB2+44OH-═2V2O5+4B2O3+22H2O | |
| B. | 正极反应式为11O2+44e-+22H2O=44OH- | |
| C. | OH-由负极透过性选择性透过膜向正极迁移 | |
| D. | 电子由硼化钒电极负载流向电极a |
分析 硼化钒-空气燃料电池中,由电池总反应为:4VB2+11O2═4B2O3+2V2O5,则VB2在负极失电子,反应式为4VB2+44OH--44e-═2V2O5+4B2O3+22H2O,氧气在正极a上得电子,反应式为11O2+44e-+22H2O=44OH-;溶液中阴离子向负极移动;电子从负极流向正极.
解答 解:A、由电池总反应为:4VB2+11O2═4B2O3+2V2O5,则VB2在负极失电子,反应式为4VB2+44OH--44e-═2V2O5+4B2O3+22H2O,故A错误;
B、氧气在正极a上得电子,反应式为11O2+44e-+22H2O=44OH-,故B正确;
C、原电池中,阴离子向负极移动,阳离子向正极移动,所以溶液中的OH-由正极透过性选择性透过膜向负极迁移,故C错误;
D、电子从负极流向正极,则电子由硼化钒电极负载流向电极a,故D正确.
故选AC.
点评 本题考查原电池的工作原理,题目难度不大,本题注意把握电极反应式的书写,正确判断离子的定向移动.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 5.3g | B. | 10.6g | C. | 14.3g | D. | 16.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ |
| 1 | 25.0 | 32.6 | |
| 2 | 25.1 | 31.8 | |
| 3 | 25.1 | 31.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
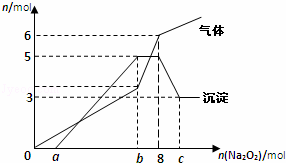 将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+的物质的量分别为( )
将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+的物质的量分别为( )| A. | 2mol、3mol、6mol | B. | 3mol、2mol、6mol | C. | 2mol、3mol、4mol | D. | 3mol、2mol、2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体部分溶解了 | |
| B. | 晶体形状和质量不变 | |
| C. | 晶体的质量增加了,形状也发生了改变 | |
| D. | 晶体的质量不变,形状改变了 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
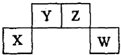 短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )| A. | 常温下X的单质投入浓硫酸中没有明显现象 | |
| B. | Y的氢化物只有一种 | |
| C. | W的氧化物对应的水化物一定是强酸 | |
| D. | Z的氧化物排放不会造成环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、CO32-、NO3- | B. | K+、Na+、NO3-、SO42- | ||
| C. | K+、MnO4-、NH4+、NO3- | D. | Na+、K+、HCO3-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com