

| 10.8g |
| 108g/mol |
| 0.1mol |
| 4 |
| ||
| ||
| ||
| ||
| 10L |
| 10-14 |
| 0.01 |


科目:高中化学 来源: 题型:
| A、在无色透明溶液中:Al3+、Na+、HCO3-、Cl- |
| B、在能使甲基橙呈红色的溶液中:Mg2+、NH4+、Fe2+、I- |
| C、加入铝粉放出氢气的溶液:K+、Ca2+、NO3-、SO42- |
| D、在水电离产生的H+的浓度为1×10-13mol?L-1的溶液:Cu2+、Na+、NO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、 灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 在Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c/mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

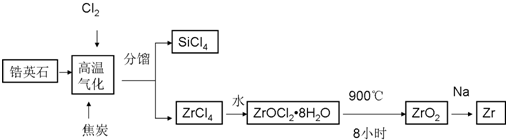
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.
某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O═AlO2-↓+4NH4++2H2O |
| B、钠投入水中:Na+H2O═Na++2OH-+H2↑ |
| C、铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
| D、氢氧化钡溶液滴入稀硫酸中:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com