
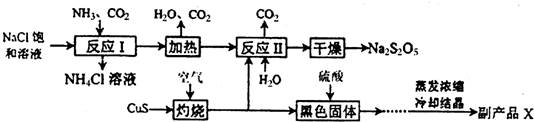
���� ��Ӧ��Ϊ����NaHCO3����������Na2CO3���ڷ�Ӧ���ж���������̼���Ʒ�Ӧ����NaHSO3�������̼������NaHSO3����Na2S2O5��
��1����������ȷ����Ӧ��ΪNaCl��NH3��CO2������ΪNH4Cl��̼�����ƣ���Ӧ�����ʱӦ��ͨ�백��������HCO3-��Ũ�ȣ�����NaHCO3�������Ȼ�麟��������ʣ�
��2��CuS��������Ӧ���ɺ�ɫ����ͭ�Ͷ����������壬���ݻ�ѧ����ʽ�ɼ����ת�Ƶ��ӵ����ʵ�����
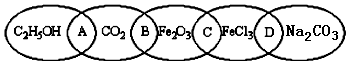
��3��Na2S2O5����Ԫ�صĻ��ϼ�Ϊ+4�ۣ����ɶ������ϼ�û�䣬��������ͼ��֪����ѭ��ʹ�õ������Ƕ�����̼��
��4����Ӧ���з�ӦӦ�Ƕ���������̼���Ʒ�Ӧ����NaHSO3��NaHSO3������Na2S2O5����Ӧ����ʽΪNa2CO3+2 SO2+H2O=2NaHSO3+CO2��Ϊ�˿������ʣ�����������̼������Ӧ����Ӧ����ʽ�б�����ϵ��Ӧ�������Ʒ�к���̼�������ʣ�����ᷴӦ���������̼���ɣ����õij���ʯ��ˮ������������ɶ�������������Ҳ��ʹ����ʯ��ˮ����ǣ���Ӧ�ȳ�ȥ�������Ը��������Һ������ɫ����ɫȷ����������������ݴ˴��⣮
��� �⣺��1������ȷ����Ӧ��ΪNaCl��NH3��CO2������ΪNH4Cl��̼�����ƣ���Ӧ��Ļ�ѧ����ʽΪ��NaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl����Ӧ�����ʱӦ��ͨ�백��������HCO3-��Ũ�ȣ�����NaHCO3������
�ʴ�Ϊ��NaCl+NH3+CO2+H2O=NaHCO3��+NH4Cl��NH3��
��2����ͭ����һ����������ͭ�Ͷ�������Ӧ�Ļ�ѧ����ʽΪ��2CuS+3O2 $\frac{\underline{\;����\;}}{\;}$2CuO+2SO2���ڸ÷�Ӧ��ÿ����2mol����������ת��12mol���ӣ���������SO21.12��l06 L����״���£���5��l04 mol����ת�Ƶ���3��l05 mol��
�ʴ�Ϊ��2CuS+3O2 $\frac{\underline{\;����\;}}{\;}$2CuO+2SO2��3��l05��
��3�������ʾ��֪���ɶ��������ˮ��Na2S2O5��ϡ���ᷴӦ�ų�SO2��ˮ����Ӧ�����ӷ���ʽΪ��S2O52-+2H+=2SO2��+H2O����������ͼ��֪����ѭ��ʹ�õ������Ƕ�����̼��
�ʴ�Ϊ��S2O52-+2H+=2SO2��+H2O��CO2��
��4�����������̿��Կ���������ͭ���壻��ͼʾ�п��Կ���������̼��ˮ�����ٴ����ã���Ӧ�������������ֱ��Ƕ��������̼���ƣ����������ʷ�Ӧ�����������������ƣ���Ӧ���з�ӦӦ�Ƕ���������̼���Ʒ�Ӧ����NaHSO3��NaHSO3������Na2S2O5����Ӧ����ʽΪNa2CO3+2SO2+H2O=2NaHSO3+CO2������������������ʵ���֮��Ϊ��2��1�������Ʒ�к���̼�������ʣ�����ᷴӦ���������̼���ɣ����õij���ʯ��ˮ������������ɶ�������������Ҳ��ʹ����ʯ��ˮ����ǣ���Ӧ�ȳ�ȥ�������Ը��������Һ������ɫ����ɫȷ�����������������ѡ�٢ܢݣ�
�ʴ�Ϊ��2��1���٢ܢݣ�
���� ���⿼�����������Ʊ���ʵ�鷽����������Ҫ���������ʵ�����Ӧ�ã����ӷ���ʽ��д������ע���Լ���ѡ���ʵ�������Ŀ�ģ����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
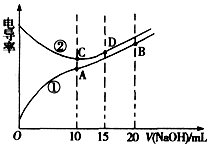
| A�� | ���ߢٴ����ζ�CH3COOH��Һ������ | |
| B�� | A����Һ�У�c��CH3COO-��+c��OH-��-c��H+��=0.05 mol��L-1 | |
| C�� | ����ͬ�¶��£�A��B��C������Һ��ˮ�����c��H+����B��A=C | |
| D�� | D����Һ�У�c��Cl-��=2c��OH-��-2c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2H2��g��+O2��g��=2H2O��l������H1 2H2��g��+O2��g��=2H2O��g������H2 | |
| B�� | S��g��+O2��g��=SO2��g������H1 S��s��+O2��g��=SO2��g����H2 | |
| C�� | H2��g��+Cl2��g��=2HCl��g������H1 $\frac{1}{2}$H2��g��+$\frac{1}{2}$Cl2��g��=HCl��g������H2 | |
| D�� | C��s��+$\frac{1}{2}$O2��g��=CO��g������H1 C��s��+O2��g��=CO2��g������H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Na2S2O3��ʼ���� | Na2S2O3 �յ���� | |
| ��һ�� | 0.10mL | 18.30mL |
| �ڶ��� | 0.30mL | 18.30mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �ζ����� | ����Һ���/ml | ���������/ml | |
| �ζ�ǰ����/ml | �ζ������/ml | ||
| ��һ�� | 10.00 | 0.20 | 22.90 |
| �ڶ��� | 10.00 | 0.50 | 20.40 |
| ������ | 10.00 | 4.00 | 24.10 |
| ���Ĵ� | 10.00 | 0.00 | 20.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
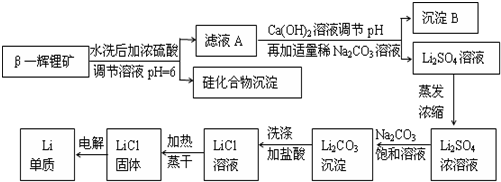
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na+�ĵ����Ų�ͼ�� | B�� | Na+�Ľṹʾ��ͼ��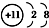 | ||
| C�� | Na�ĵ����Ų�ʽ��1s22s22p63s1 | D�� | Na�ļ����Ų�ʽ��[Ne]3s1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �� | B�� | �մ� | C�� | ���� | D�� | �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com