
| A. | 向含有FeI2的溶液中通入适量氯气,当有1mo1Fe2+被氧化时,该反应转移电子数目为3NA | |
| B. | 40gCuO和Cu2S混合物中所含铜原子的数目不等于0.5NA | |
| C. | 含0.1mo1NH4HSO4的溶液中,阳离子数目略小于0.2NA | |
| D. | C3H8分子中的2个H原子分别被1个-NH2和一个-OH取代,1mol此有机物所含共用电子对数目为13NA |
分析 A.碘离子的还原性强于二价铁离子,氯气先氧化碘离子,再氧化二价铁离子;
B.CuO和Cu2S中铜元素的质量分数相等,都是80%;
C.硫酸氢铵电离的产生硫酸根离子、氢离子、硫酸根离子;
D.C3H8分子中的2个H原子分别被1个-NH2和一个-OH取代,得到物质中1个分子含有13对共用电子对.
解答 解:A.向含有FeI2的溶液中通入适量氯气,氯气先氧化I-,当有1mol Fe2+被氧化时转移NA个电子;2mol I-被氧化时转移2NA个电子;该反应转移电子的数目至少为3NA,故A错误;
B.40gCuO和Cu2S的混合物中含有铜元素的质量为:40g×$\frac{64}{80}$=32g,含有的铜的物质的量为0.5mol,含有铜原子数一定为0.5NA,故B错误;
C.含0.1mo1NH4HSO4的溶液中,电离产生0.1mol铵根离子、0.1mol氢离子,1mol氨根离子水解生成1mol氢离子,所以阳离子数目等于0.2NA,故C错误;
D.C3H8分子中的2个H原子分别被1个-NH2和一个-OH取代,得到物质中1个分子含有13对共用电子对,则1mol此有机物所含共用电子对数目为13NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数及其应用有机物结构,题目难度不大,注意气体摩尔体积条件应用.掌握基础是解题关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>b | B. | 阴离子的还原性:Y2-<Z- | ||
| C. | 离子半径:X+>W3+ | D. | 氢化物的稳定性:H2Y>HZ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 起始浓度/mol•L-1 | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | X | 0.2 | 7 |
| A. | 实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+) | |
| B. | 实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=$\frac{{K}_{W}}{1×1{0}^{-5}}$mol•L-1 | |
| C. | 实验②反应后的溶液中:c(A-)+c(HA)>0.1mol•L-1 | |
| D. | 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用新制的氢氧化铜不能区分乙醇,乙酸 | |
| B. | (CH3)2CHCH(CH3)2的名称是2,3-二甲基丁烷 | |
| C. | 近日,南充周边地市发生人感染H7N9禽流感病毒病例,该病毒可被高温和紫外线杀灭,利用了蛋白质变性的原理 | |
| D. | CH4和C10H22互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
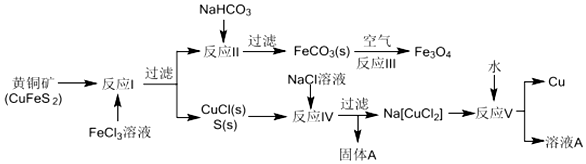
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑦ | B. | ②③⑤⑦ | C. | ①④⑥⑦ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.1gCl2与足量NaOH溶液反应转移0.2×6.02×1023个电子 | |
| B. | 1mol羟基中含有的电子数目为9×6.02×1023个 | |
| C. | 标准状况下,2.24L辛烷含有0.8×6.02×1023个碳原子 | |
| D. | 1L 0.50mol/L Na2CO3溶液中含有1.5×6.02×1023个离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com