
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 稳定性:盐酸>硅酸 |
| B | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成血红色 | 溶液中含有Fe3+,没有Fe2+ |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
| D | 向盛有碘水的试管中加入CCl4后充分振荡静置 | 液体分层,上层基本无色,下层紫色 | 碘在CCl4中的溶解度较大 |
| A、A | B、B | C、C | D、D |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
 (1)用惰性电极电解CuSO4溶液(如图的装置),该过程中电解池电极反应式为是阳极:
(1)用惰性电极电解CuSO4溶液(如图的装置),该过程中电解池电极反应式为是阳极:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、T℃时,1L pH=6的纯水中,含有的OH-数目为l×10-8NA |
| B、一定条件下,2.3g的Na完全与O2反应生成 3.6g产物时失去的电子数为0.1NA |
| C、1.0L的0.1 mol?L-1Na2S溶液中含有的S2-离子数为0.1NA |
| D、标准状况下,22.4L的SO3中含有的SO3分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验 | 解释或结论 |
| A | 用洁净的Pt蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有Na+,无k+ |
| B | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧 | CO2、H2O与Na2O2反应是放热反应 |
| C | 向溴水中滴入植物油,振荡后,油层显无色 | 溴不溶于油脂 |
| D | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色 | H2O2的氧化性比Fe3+强 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、I-、Cl-、ClO-、Na+ |
| B、K+、Ba2+、OH-、NO3- |
| C、H+、Fe2+、NO3-、MnO4- |
| D、Al3+、NH4+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
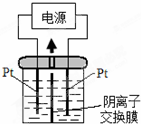 电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )
电解装置如图,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法正确的是( )| A、右侧发生的电极方程式:O2+4e-+2H2O=4OH- |
| B、电解槽内发生反应的总化学方程式是KI+3H2O=KIO3+3H2↑ |
| C、电解结束后,右侧溶液中不可能含有IO3- |
| D、如果用阳离子交换膜代替阴离子交换膜,电解槽内反应的总化学方程式不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2+H2O?Cl-+H++HClO | ||||
| B、NaH+H2O═NaOH+H2↑ | ||||
| C、2Na+2H2O═2NaOH+H2↑ | ||||
D、2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 含有油污的织物用CCl4或热的Na2CO3溶液浸泡 | 油污均去除 | 去污原理相同 |
| B | 向溶液X 中先滴加氯水,再滴加KSCN溶液 | 溶液变红 | 溶液X中一定含有Fe2+ |
| C | 浓度相同的ZnCl2、CuCl2溶液中,滴入少量Na2S溶液 | 只有黑色沉淀 | Ksp(CuS)>Ksp(ZnS) |
| D | 洁净的铁钉在浓硝酸中浸泡片刻,蒸馏水冲洗后,再放入CuSO4溶液 | 铁钉表面无红色 物质生成 |
铁钉在浓硝酸中已钝化 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度( ) | 360 | 440 | 520 |
| K | 0.036 | 0.010 | 0.0038 |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com