
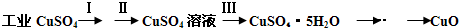
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:阅读理解
| Ⅰ |
| Ⅱ |
| Ⅲ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
| Ⅰ |
| Ⅱ |
| Ⅲ |

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)制备氧化铜
![]() CuSO4·5H2O……CuO
CuSO4·5H2O……CuO
①步骤Ⅰ的目的是除不溶性杂质。操作是___________________________________________。
②步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热:Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是_________。
③步骤Ⅲ的目的是得到CuSO4·5H2O晶体,操作是__________________。水浴加热烘干。水浴加热的特点是___________________________________________________________。
(2)探究氧化铜性质
①取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡,结论是____________________________________________。
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器有______________。
查看答案和解析>>
科目:高中化学 来源:2013届辽宁省沈阳市第二十中学高三高考领航考试(二)化学试卷(带解析) 题型:填空题
氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com