
【题目】反应8NH3+3Cl2=N2+6NH4Cl,被氧化的NH3与被还原的Cl2的物质的量之比为( )
A.3:2B.8:3C.6:3D.2:3
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,向一带活塞的密闭容器中充入2mol A和1mol B,发生下列反应:
2A(g)+B(g)2C(g)△H<0.达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图.下列对t1时刻改变条件的推测中正确的是( )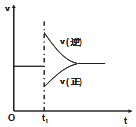
A.保持压强不变,升高反应温度
B.保持温度不变,增大容器体积
C.保持温度和容器体积不变,充入1 mol C(g)
D.保持温度和压强不变,充入1 mol C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
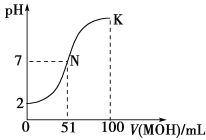
(1)由图中信息可知HA为________酸(填“强”或“弱”),理由是_______________。
(2)MA稀溶液的pH=a,则a________7(填“>”“<”或“=”),用离子方程式表示其原因为_______________,此时,溶液中由水电离出的c(OH-)=________。
(3)请写出K点所对应的溶液中离子浓度的大小关系:________。
(4)K点对应的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”“<”或“=”);若此时溶液中pH=10,则c(MOH)+c(OH-)=________mol·L-1(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,Ksp(Ag2CrO4)=1.1×10-12。下列说法中正确的是( )
A.由于Ksp(AgCl)>Ksp(AgI),所以AgI可以转化为AgCl
B.向Ag2CrO4溶液中加入固体K2CrO4,溶解平衡逆向移动,所以Ag2CrO4的Ksp减小
C.由于Ksp(Ag2CrO4)<Ksp(AgCl),所以沉淀AgCl容易转化为沉淀Ag2CrO4
D.常温下,AgCl饱和溶液中加入NaI,若要使溶液中开始转化为AgI,则NaI的浓度必不低于0.75×10-11 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于Ag2S(s)![]() 2Ag+(aq)+S2-(aq),其Ksp的表达式为________。
2Ag+(aq)+S2-(aq),其Ksp的表达式为________。
(2)下列说法不正确的是______________(填序号)。
①用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl少
②一般地,物质的溶解度随温度的升高而增加,故物质的溶解大多是吸热的
③对于Al(OH)3(s) ![]() Al(OH)3(aq)
Al(OH)3(aq) ![]() Al3++3OH-,前者为溶解平衡,后者为电离平衡
Al3++3OH-,前者为溶解平衡,后者为电离平衡
④除去溶液中的Mg2+,用OH-沉淀比用CO![]() 好,说明Mg(OH)2的溶解度比MgCO3的大
好,说明Mg(OH)2的溶解度比MgCO3的大
⑤沉淀反应中常加过量的沉淀剂,其目的是使沉淀更完全
(3)如何除去Mg(OH)2中混有的Ca(OH)2?
___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他材料电池,电池总反应为V2O5+xLi ![]() LixV2O5 . 下列说法中正确的是( )
LixV2O5 . 下列说法中正确的是( )
A.电池在放电时,Li+向负极移动
B.锂在放电时做正极,充电时为阳极
C.该电池充电时阳极的反应为LixV2O5﹣xe﹣═V2O5+xLi+
D.V2O5只是锂发生反应的载体,不参与电池反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol·L-1)如图所示。

(1)pH=3时溶液中铜元素的主要存在形式是________________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液范围在pH ( )
A. <1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是__________________________。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水生成[Cu(NH3)4]2+,写出反应的离子方程式__________________________。
(5)已知一些难溶物的溶度积常数如下表。
物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的________(填选项)。
A.NaOH B.FeS C.Na2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中酸性最强的是( )
A.PH=4
B.C(H+)=1×10﹣3 molL﹣1
C.C(OH﹣)=1×10﹣12
D.C(H+)/C(OH﹣)=1012
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com