
| A. | 若X的反应速率为0.2 mol•L-1•s-1,则Z的反应速率为0.3 mol•L-1•s-1 | |
| B. | 若向容器中充入氦气,压强增大,Y的转化率提高 | |
| C. | 升高温度,正反应速率减小,平衡向逆反应方向移动 | |
| D. | 开始充入容器中的X、Y物质的量之比为2:1 |
分析 A.化学反应速率之比等于其化学计量数之比;
B.若向容器中充入氦气,恒容容器充入惰气总压增大,反应混合物各组分浓度不变,平衡不动;
C.升高温度,正逆反应速率增大,平衡向吸热反应方向移动;
D.开始充入容器中的X、Y分别为xmol和ymol,结合转化率表示出参加反应X、Y的物质的量,物质的量变化量之比等于化学计量数之比.
解答 解:A.化学反应速率之比等于其化学计量数之比,若X的反应速率为0.2 mol•L-1•s-1,则Z的反应速率为$\frac{2}{3}$×0.2 mol•L-1•s-1=$\frac{2}{15}$mol/(L•s),故A错误;
B.若向容器中充入氦气,恒容容器充入惰气总压增大,反应混合物各组分浓度不变,平衡不动,Y的转化率不变,故B错误;
C.升高温度,正逆反应速率增大,正反应为放热反应,平衡向逆反应方向移动,故C错误;
D.开始充入容器中的X、Y分别为xmol和ymol,则转化的X为37.5%×xmol,Y的转化率为25%×y mol,则:37.5%×xmol:25%×y mol=3:1,整理可得x:y=2:1,故D正确;
故选D.
点评 本题考查化学平衡计算与影响因素、反应速率计算等,注意压强改变影响平衡移动本质是影响物质浓度.


科目:高中化学 来源: 题型:选择题
| A. | 直接往该溶液中滴加稀H2S04后产生大量气泡,证明原溶液含C032- | |
| B. | 取少量溶液加入Ba(NO3)2溶液后产生白色沉淀,证明原溶液中含SO42- | |
| C. | 取少量溶液加入HCl酸化后滴加AgN03溶液产生白色沉淀,证明原溶液中含Cl-. | |
| D. | 取少量溶液加入HCl酸化后滴加BaCL2溶液产生白色沉淀,证明原溶液中含SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
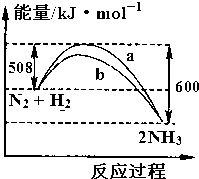
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ•mol-1 | |
| B. | 向一密闭容器中加入1 molN2和3 molH2充分反应后,放出92 kJ热量 | |
| C. | b曲线可能是加入催化剂时的能量变化曲线 | |
| D. | 在N2+3H2?2NH3中,反应物的键能之和大于生成物的键能之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | 等物质的量的水与重水含有相同数目的中子数 | |
| C. | 氯分子的电子式: | |
| D. | 恒温恒容条件下HI分解成气态I2的反应,体系的总压强保持不变时,说明反应处于平衡态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大 | |
| B. | 将硫酸铝和氯化铝溶液分别加热蒸干后灼烧,得到的固体都是氧化铝 | |
| C. | 中和体积与物质的量浓度都相同的HCl溶液和CH3COOH溶液消耗NaOH物质的量相同 | |
| D. | 中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗NaOH物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(NO3)2 | B. | Fe(NO3)3 | C. | Fe(NO3)2 | D. | Fe(NO3)2和Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅① | B. | 仅①② | C. | 仅①②③ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com