
【题目】我国有丰富的海水资源,海水中的元素共含有80多种,总储量很大。常量元素包括H、B、C、O、F、Na、Mg、S、Cl、K、Ca、Br、Sr等13种元素,同时还含有Cr、Mn、Fe、Ni、Cu、Zn等微量元素,因此开发利用海水资源具有非常广阔的前景。
(1)上述涉及到的元素中,不属于前四周期的是___,基态原子中的未成对电子数最多是___(写元素符号)。
(2)基态Fe3+的价电子排布式___,基态B原子的电子排布图为___。
(3)B、C、O、F四种元素基态原子第一电离能由大到小的顺序为___(写元素符号)。
(4)CO32-的中心原子价层电子对数为___对,SO32-的空间构型为___,HCHO中C的杂化方式为___。
(5)氨气极易溶于水的主要原因之一为NH3与H2O分子之间可以形成氢键,氨水中存在的氢键有___种。
(6)干冰与水晶熔化需破坏的主要作用分别是___、___。
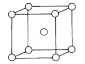
(7)已知钠的密度为ag/cm3,NA为阿伏加德罗常数的值,钠的晶胞结构如图,则晶胞棱长为___ pm。
【答案】Sr Cr 3d5 ![]() F、O、C、B 3 三角锥形 sp2 4 范德华力(或分子间作用力) 共价键
F、O、C、B 3 三角锥形 sp2 4 范德华力(或分子间作用力) 共价键 ![]() ×1010
×1010
【解析】
(1)1-36号元素为前四周期的元素;上述涉及到的元素中,Sr为38号元素,不在前四周期;Cr原子核外电子排布式为1s22s22p63s23p63d54s1,价层电子全部处于半充满状态,未成对电子数最多;
(2)基态Fe原子的核外电子排布式1s22s22p63s23p63d64s2,Fe3+的价电子排布式3d5;基态B原子的核外电子排布式为1s22s22p1,电子排布图为![]() ;
;
(3)B、C、O、F为同周期元素,同周期元素从左至右,第一电离能有逐渐增大的趋势,则四种元素基态原子第一电离能由大到小的顺序为F、O、C、B;
(4)CO32-的中心原子为C原子,价层电子对数为3+![]() ×(4+2-2×3)=3对;SO32-的中心原子为S原子,价层电子对数=3+
×(4+2-2×3)=3对;SO32-的中心原子为S原子,价层电子对数=3+![]() ×(6+2-2×3)=4,为sp3杂化,由4个原子构成的微粒,空间构型为三角锥形;HCHO中C的键连方式有碳氧双键,整个分子为平面结构,则杂化方式为sp2;
×(6+2-2×3)=4,为sp3杂化,由4个原子构成的微粒,空间构型为三角锥形;HCHO中C的键连方式有碳氧双键,整个分子为平面结构,则杂化方式为sp2;
(5)氨水氧原子和氮原子与氢原子中存在的氢键,水分子与水分子之间,水分子与氨气分子之间、氨气分子与氨气分子之间,形成氢键可表示为O—H … N、O—H … O、N—H … N 、N—H … O,则氨水中存在的氢键有4种;
(6)干冰属于分子晶体,熔化时破坏分子间作用力(即范德华力),水晶主要成分是二氧化硅,属于原子晶体,熔化是破坏共价键;
(7)钠原子位于晶胞的顶点和体心,则该晶胞中钠原子的个数=![]() ×8+1=2,设晶胞的棱长为xcm,则晶胞的体积V=x3cm3,根据ρ=
×8+1=2,设晶胞的棱长为xcm,则晶胞的体积V=x3cm3,根据ρ=![]() ,则x=
,则x=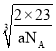 cm=
cm=![]() ×1010pm。
×1010pm。


科目:高中化学 来源: 题型:
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-38 |
回答下列问题:
(1)该电池的正极反应式为___,电池反应的离子方程式为:___。
(2)维持电流强度为0.5A,电池工作十分钟,理论上消耗Zn___g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过__分离回收;滤渣的主要成分是MnO2、___和___,欲从中得到较纯的MnO2,最简便的方法是在空气中加热,其原理是___。
(4)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为__,加碱调节至pH为__时,铁刚好完全沉淀;继续加碱调节至pH为___时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是___,原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是
A. 3g 3He含有的中子数为1NA
B. 1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C. 1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D. 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子P的合成路线如下:
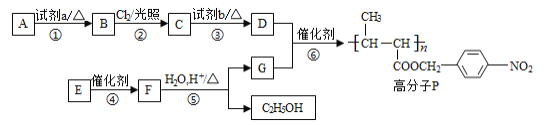
(1)A的分子式是C7H8,其结构简式是________。
(2)试剂a是_______。
(3)反应③的化学方程式:________。
(4)E的分子式是C6H10O2。E中含有的官能团:_________。
(5)反应④的反应类型是________。
(6)反应⑤的化学方程式:________。
(7)已知:2CH3CHO ![]() 。以乙烯为起始原料,选用必要的无机试剂合成E,合成路线如下,写出 I,J 的结构简式:________、________
。以乙烯为起始原料,选用必要的无机试剂合成E,合成路线如下,写出 I,J 的结构简式:________、________
CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]() (I)
(I)![]()
![]()
![]()
![]()
![]() (J)
(J)![]() E
E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—锑液态金属电池是新型二次电池,白天利用太阳能给电池充电,夜晚电池可以给外电路供电。该电池利用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。工作原理如图所示,下列有关该二次电池说法正确的是( )

A.该电池放电时,C1-向下层方向移动
B.充电时,阴极的电极反应为:Mg2++2e-=Mg
C.该电池充电时,Mg—Sb(液)层做阴极
D.放电时,Mg(液)层的质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A.干粉灭火器和泡沫灭火器的工作原理相同
B.实验室配制1.0 molL-1的NaOH溶液定容时俯视刻度线,配制溶液浓度偏低
C.国产大飞机C919发动机使用的氮化硅属于无机非金属材料
D.冰水混合物、四氧化三铁、纯净矿泉水都不是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,按要求回答问题:
① |
| ||||||||||||||||
|
|
| ② | ③ | ④ |
|
| ||||||||||
⑤ | ⑥ |
|
|
|
|
|
|
|
|
|
| ⑦ |
|
| ⑧ | ⑨ |
|
(1)元素④在周期表中位置是_______。元素③的最高价氧化物的化学式为________。
(2)元素①⑤组成化合物电子式为___________。
(3)元素②的单质与⑧的最高价氧化物的水化物热的浓溶液反应的化学方程式为___。
(4)元素⑦与⑨形成的化合物与元素③的氢化物的水溶液反应的离子方程式为_____。
(5)元素④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为_____(用离子符号表示)。
(6)A—F发生如图所示的转化,A、B、C、D为①—⑨中某种元素形成的单质,E、F、G为B、C、D与A形成的二元化合物,G是一种常见温室气体,与B可以反应生成E,E中B元素的质量分数为60%,F为两性物质。

①A和F的化学式分别为_______、_______。
②B与G反应的化学方程式为____________________。
③C与NaOH溶液反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大,在下列转化关系中,甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物。其中A为d元素组成的单质,常温下乙为液体,丁物质常用于消毒、漂白。下列说法错误的是
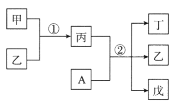
A.简单离子半径:c>b
B.丙中既有离子键又有极性键
C.b、c形成的化合物中阴、阳离子数目比为1:2
D.a、b、d形成的化合物中,d的杂化方式是sp3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行硫酸铜晶体(![]() )结晶水含量的测定实验。完成下列填空:
)结晶水含量的测定实验。完成下列填空:
(实验步骤):
(1)在__________(填仪器名称)准确称量瓷坩埚的质量。
(2)在瓷坩埚中加入一定量的硫酸铜晶体,并称重。
(3)把盛有硫酸铜晶体的瓷坩埚放在泥三角上慢慢加热,直到蓝色完全变白,然后把坩埚移至_______(填仪器名称)中冷却到室温,并称重。
(4)重复上述实验进行恒重操作,其目的是_______________,直到两次称量结果不超过______克。
(5)下面是该学生实验的一次数据,请完成计算:
坩埚质量(克) | 坩埚与晶体的质量(克) | 恒重后坩埚与固体质量 |
13.721 | 24.692 | 20.631 |
![]() ______;(精确到0.01)实验相对误差是_________(保留小数后一位)。
______;(精确到0.01)实验相对误差是_________(保留小数后一位)。
(6)这次实验中产生误差的原因可能是_______
a. 硫酸铜晶体中含有不挥发性杂质 b. 在加热过程中发现有黑色物质生成
c. 加热时有晶体飞溅出来 d. 加热失水后露置在空气中冷却
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com