
| A. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu互为同素异形体 | |
| C. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu具有相同的最外层电子数 | |
| D. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U具有完全相同的化学性质 |
分析 A.质子数相同中子数不同的同种元素的不同原子为同位素;
B.同种元素组成的不同单质;
C..同种元素组成的不同单质为同素异形体;
D.质子数不同最外层电子数不同,化学性质不同.
解答 解:A.${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U质子数不同为不同元素原子,不互为同位素,故A错误;
B.${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu是元素的不同原子互为同位素,不是同素异形体,故B错误;
C.${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu质子数相同,具有相同的最外层电子数,故C正确;
D.${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U是不同元素原子,最外层电子数不同,化学性质不同,故D错误;
故选C.
点评 本题考查了原子结构、质量数=质子数+中子数,注意同位素、同素异形体等风险,元素化学性质决定于原子最外层电子数,题目难度中等.


 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:实验题
 工业上,向500℃左右的铁屑中通入Cl2生产无水氯化铁,其制备过程中均要确保无水.现模拟该过程用图示装置进行实验:
工业上,向500℃左右的铁屑中通入Cl2生产无水氯化铁,其制备过程中均要确保无水.现模拟该过程用图示装置进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al 的第一电离能逐渐增大 | B. | O、F、N 的电负性逐渐增大 | ||
| C. | S2-、Cl-、K+的半径逐渐增大 | D. | 热稳定性:HF>H2O>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
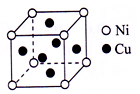 苏州工匠用白铜打造的食蟹工具“蟹八件”,主要成分是铜镍合金.Ni能与CO形成正四面体形的配合物Ni(CO)4,CuSO4溶于氨水形成SO4深蓝色溶液.
苏州工匠用白铜打造的食蟹工具“蟹八件”,主要成分是铜镍合金.Ni能与CO形成正四面体形的配合物Ni(CO)4,CuSO4溶于氨水形成SO4深蓝色溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4 L C2H6中含共价键的数目为6 NA | |
| B. | 5 g KHCO3与CaCO3混合固体中阴离子数目为0.05 NA | |
| C. | 常温下,1 L 0.1 mol•L-1CH3COONa溶液中CH3COO-离子数目为0.1 NA | |
| D. | 在Na2O2与H2O的反应中,当转移0.2 NA个电子时生成的O2体积为2.24 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgF2的电子式: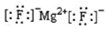 | |
| B. | 中子数为15的硅原子:${\;}_{14}^{29}$Si | |
| C. | 乙烯的结构简式:CH2CH2 | |
| D. | NH3•H2O 的电离方程式:NH3•H2O?NH4++OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com