
| A. | 原子半径的大小:W>Z>X | |
| B. | 气态氢化物的还原性:Y>M | |
| C. | 最高价氧化物的水化物的酸性:M>W | |
| D. | X与Y可形成10电子分子和18电子分子 |
分析 X、Y、Z、M、W五种主族元素分属三个短周期,且原子序数依次增大.X、Z同族,可形成离子化合物ZX,可知X为H,Z为Na;Y、M同主族,可形成MY2、MY3两种分子,则Y为O,M为S,W的原子序数最大,W为Cl,以此来解答.
解答 解:由上述分析可知,X为H,Y为O,Z为Na,M为S,W为Cl,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径的大小:Z>W>X,故A错误;
B.非金属性Y>M,则气态氢化物的还原性:Y<M,故B错误;
C.非金属性M<W,则最高价氧化物的水化物的酸性:M<W,故C错误;
D.X与Y可形成10电子分子和18电子分子,分别为水、过氧化氢,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、元素化合物知识推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | nCH2=CH2$\stackrel{催化剂}{→}$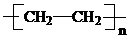 | |
| B. | CH2=CH2+Br2→CH3CHBr2 | |
| C. | 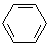 +HNO3$→_{60℃}^{浓硫酸}$ +HNO3$→_{60℃}^{浓硫酸}$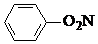 +H2O +H2O | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH3CH2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q、R的最高价氧化物对应水化物间可反应 | |
| B. | Y的简单氢化物比Z的简单氢化物稳定 | |
| C. | 可通过电解熔融氯化物的方法制备Q、R | |
| D. | X元素单质在化学反应中只表现还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸测得:0.1mol•L-1Na2SO3溶液的pH约为10;0.1mol•L-1NaHSO3溶液的pH约为5 | HSO3-结合H+的能力比SO32-强 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 配置FeCl2溶液时,先将FeCl2固体溶于适量盐酸中,再用蒸馏水稀释到所需浓度,最后向试剂瓶中加入少量铜粉 | 抑制Fe2+2水解,并防止Fe2+被氧化 |
| D | 向10mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,在滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
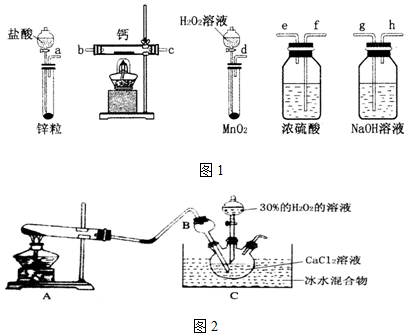
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基丁烷也称异丁烷 | |
| B. | 乙烯、苯都能发生加成反应 | |
| C. | 乙烯、聚氯乙烯分子中都含有碳碳双键 | |
| D. | 淀粉、油脂、蛋白质都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 乙烯是石油化工的重要产品,以乙烯为原料制备一些化工产品的流程如图:
乙烯是石油化工的重要产品,以乙烯为原料制备一些化工产品的流程如图: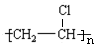
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
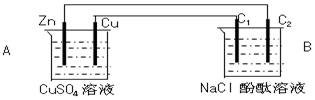 按如图装置进行实验,并回答下列问题
按如图装置进行实验,并回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com