
| A. | AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O | |
| B. | 漂白粉溶液中通入适量的SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| C. | 用稀硝酸除去试管内壁银:3Ag+4H++NO3-=3Ag++NO↑+2H2O | |
| D. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
分析 A.反应生成氢氧化铝和氯化铵;
B.发生氧化还原反应生成硫酸钙;
C.反应生成硝酸银、NO和水;
D.少量小苏打完全反应,生成碳酸钙、NaOH和水.
解答 解:A.向AlCl3溶液中加入过量的氨水,其离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.漂白粉溶液中通入适量的SO2气体,发生氧化还原反应为SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故B错误;
C.用稀硝酸除去试管内壁银的离子反应为3Ag+4H++NO3-=3Ag++NO↑+2H2O,故C正确;
D.澄清石灰水与少量小苏打溶液混合的离子反应为Ca2++OH-+HCO3-=CaCO3↓+H2O,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意与量有关的离子反应、氧化还原反应的判断,题目难度不大.


科目:高中化学 来源: 题型:实验题
| 化学式 | HCOOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
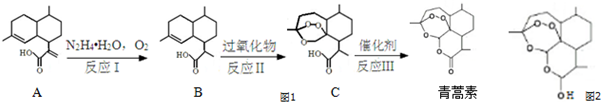
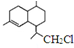 为原料合成B,写出其合成路线(指明所用试剂和反应条件).
为原料合成B,写出其合成路线(指明所用试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
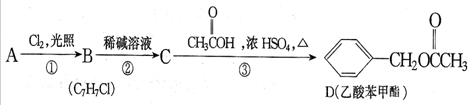
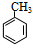 .
.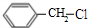 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$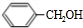 +NaCl.
+NaCl.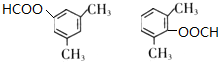 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
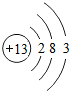 ,其最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
,其最高价氧化物的水化物与氢氧化钠溶液反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O. ,其中一种氢化物在常温下与MnO2混合的反应化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
,其中一种氢化物在常温下与MnO2混合的反应化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑. ,高温灼伤该化合物时,火焰呈黄色.
,高温灼伤该化合物时,火焰呈黄色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品 | |
| B. | NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂 | |
| C. | 药皂中加入少量苯酚,可以起到杀菌消毒的作用 | |
| D. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com