
 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��c(NH4+)��c(Cl-) | B��c(H+)=c(OH-) |
| C��c(NH4+)��c(Cl-) | D��c(OH-)��c(Cl-)��c(H+)��(NH4+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2:1 | B��21:1 | C��20:1 | D��22:1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ij������Һ��pH��a��������Һϡ��1������Һ��pH��b����a>b |
| B��0.2mol/L��0.1mol/L������c(H+)֮��Ϊ2:1 |
C�� 1.0��10��3 mol/L�����pH��3.0, 1.0��10��8 mol/L�����pH��8.0 1.0��10��3 mol/L�����pH��3.0, 1.0��10��8 mol/L�����pH��8.0 |
| D����1mLpH=1��������100mL NaOH��Һ��Ϻ���Һ��pH=7����NaOH��Һ��pH=11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ���ǣ� ��
���ǣ� ��| A��HCO3�������ڸ���Һ��һ�����ܴ������� | B������Һ��pHһ����12 |
| C�������Һ�м�����Ƭ��һ������������ | D��������Һ������ֻ��һ�֣���һ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
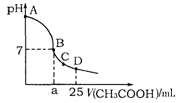
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ú��ʯ�͡���Ȼ����Ϊ��ʯ��Դ |
| B����ʯȼ����ȼ�չ������ܲ�����Ⱦ������SO2���к����� |
| C��ֱ��ȼ��ú���罫ú������ӹ�����ȼ��Ч���� |
| D����ʯ��Դ�ǿ�������Դ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��KOH | B��NH3��H2O | C��Ba(OH)2 | D��NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ʱ���ų�445KJ�������������Ȼ�ѧ����ʽ��ȷ����
ʱ���ų�445KJ�������������Ȼ�ѧ����ʽ��ȷ���� g)= 1/2CO2(g)
g)= 1/2CO2(g)  +H2O(l) ��H=-890KJ/mol
+H2O(l) ��H=-890KJ/mol�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com