
| A. | 若D与盐酸反应,可生成A和B,则X一定是H2O | |
| B. | 若D为NaCl,且A可与C反应生成B,则E 可能是CO2 | |
| C. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| D. | 若D是一种强酸,则A既可以是单质,也可以是化合物 |
分析 A.FeCl3$\stackrel{Zn}{→}$FeCl2$\stackrel{Zn}{→}$Fe$\stackrel{O_{2}}{→}$Fe3O4;
B.NaOH $\stackrel{CO_{2}}{→}$Na2CO3 $\stackrel{CO_{2}}{→}$NaHCO3$\stackrel{HCl}{→}$NaCl;
C.Na$\stackrel{O_{2}}{→}$Na2O$\stackrel{O_{2}}{→}$Na2O2$\stackrel{H_{2}O}{→}$NaOH;
D.N2(NH3)$\stackrel{O_{2}}{→}$NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3.
解答 解:A.符合条件的只有FeCl3$\stackrel{Zn}{→}$FeCl2$\stackrel{Zn}{→}$Fe$\stackrel{O_{2}}{→}$Fe3O4,X不仅可以为H2O,还可为O2,另外Fe不是短周期元素,故A错误;
B.若D为NaCl,且A可与C反应生成B,则E可能是CO2,反应关系为:NaOH $\stackrel{CO_{2}}{→}$Na2CO3 $\stackrel{CO_{2}}{→}$NaHCO3$\stackrel{HCl}{→}$NaCl,故B正确;
C.若D是一种强碱,A可能为Na,反应关系为Na$\stackrel{O_{2}}{→}$Na2O$\stackrel{O_{2}}{→}$Na2O2$\stackrel{H_{2}O}{→}$NaOH,故C正确;
D.若D是一种强酸,则A既可以是单质,也可以是化合物,反应关系为N2(NH3)$\stackrel{O_{2}}{→}$NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3,故D正确;
故选A.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、相互转化为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的综合应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
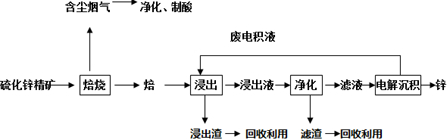
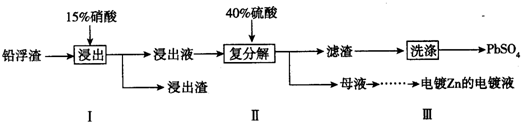
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 5.2 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木炭在氧气中燃烧,发出白光,放出热量,产生能使澄清石灰水变浑浊的气体 | |
| B. | 细铁丝在空气里剧烈燃烧,火星四射,生成黑色固体物质 | |
| C. | 硫在氧气中燃烧,发出黄色火焰,生成无色有刺激性气味的气体 | |
| D. | 加热铜绿时,生成黑色氧化铜固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于3:8 | B. | 大于3:8 | C. | 小于或等于3:8 | D. | 大于3:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com