
 或
或
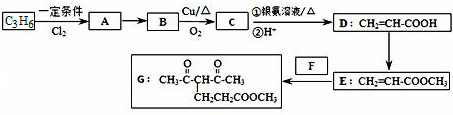
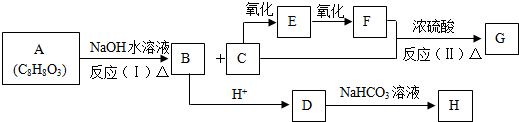
分析 C发生银镜反应生成丙烯酸D,则C为CH2=CHCHO,B发生氧化反应生成C,B为CH2=CHCH2OH,丙烯和氯气发生取代反应生成A,A为CH2=CHCH2Cl,A发生取代反应生成B,D发生酯化反应生成E,结构题给信息知,E、F发生加成反应生成G,F结构简式为CH3COCH2COCH3,结合题目分析解答.
解答 解:C发生银镜反应生成丙烯酸D,则C为CH2=CHCHO,B发生氧化反应生成C,B为CH2=CHCH2OH,丙烯和氯气发生取代反应生成A,A为CH2=CHCH2Cl,A发生取代反应生成B,D发生酯化反应生成E,结构题给信息知,E、F发生加成反应生成G,F结构简式为CH3COCH2COCH3,
(1)D中官能团的名称为碳碳双键、羧基;羰基能和氢气发生加成反应,一个G分子中含有两个羰基,则1molG发生加成反应时最多消耗2molH2,故答案为:碳碳双键、羧基;2;
(2)D中含有羧基能和碳酸钠反应生成丙烯酸钠,E不能溶于饱和碳酸钠,所以除掉E中含有的少量D的试剂是饱和碳酸钠,其操作方法是:向混合溶液中加入饱和碳酸钠溶液,充分振荡后静置、分液;
E中含有碳碳双键和酯基,具有烯烃和酯的性质,
A.不含酚羟基,所以遇FeCl3溶液不呈紫色,故错误;
B.E和碳酸氢钠不反应,故错误;
C.含有酯基,所以可发生取代反应,故正确;
D.E中含有酯基,所以与CH2=CHCOOH不是同系物,故错误;
E.酯不易溶于水,故错误;
F.属于有机物,可发生氧化反应,故正确;
故答案为:向溶液中加入饱和碳酸钠溶液,充分振荡后静置、分液;CF;
(3)B为CH2=CHCH2OH,A为CH2=CHCH2Cl,A和NaOH的水溶液加热生成B,反应方程式为
CH2=CHCH2Cl+NaOH$→_{△}^{H_{2}O}$CH2=CHCH2OH+NaCl;
C为CH2=CHCHO、D是C为CH2=CHCOOH,C被氧化生成D,反应方程式为
CH2=CHCHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH2=CHCOONH4+2Ag↓+3NH3+H2O,
故答案为:CH2=CHCH2Cl+NaOH$→_{△}^{H_{2}O}$CH2=CHCH2OH+NaCl;CH2=CHCHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH2=CHCOONH4+2Ag↓+3NH3+H2O;
(4)E、F发生加成反应生成G,F结构简式为CH3COCH2COCH3,故答案为:CH3COCH2COCH3;
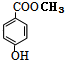
(5)比G少2个氢原子的物质具有下列性质,①遇FeCl3溶液呈紫色说明含有苯环、②苯环上的一氯代物只有一种说明苯环上只有一种氢原子、③1mol该物质最多可消耗1molNa或2molNaOH说明含有1个醇羟基和一个酚羟基,符合条件物质的结构简式为 或
或 ,
,
故答案为: 或
或 .
.
点评 本题考查有机物推断,为高考高频点,以D结构为突破口采用正逆结合的方法进行推断,结合题给信息、反应条件进行推断,同时考查学生知识迁移能力,难点是(5)中同分异构体判断,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 ;B:
;B: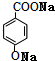 ;E:HCHO G:HCOOCH3
;E:HCHO G:HCOOCH3 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 非金属性比硫弱 | B. | 氢化物比HBr稳定 | ||
| C. | 原子序数为34 | D. | 最高价氧化物的水化物显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
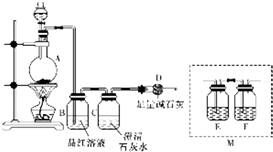 为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究.往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯.
为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究.往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
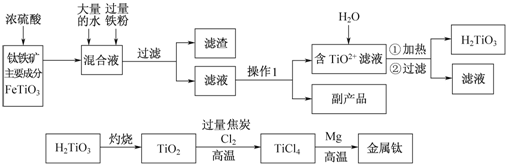
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
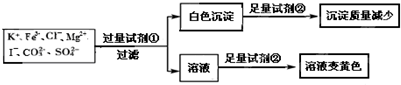
| A. | 该溶液中一定有I-、CO32-、SO42-、K+ | |
| B. | 试剂①为硝酸钡 | |
| C. | 通过黄色溶液中加入硝酸银可以检验原溶液中是否存在Cl- | |
| D. | 试剂②一定为盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
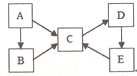 构建知识网络体系,有助于知识的有序储存和应用.下图A、B、C、D、E五种物质均含有同一种元素,它们之间有如图转化关系:
构建知识网络体系,有助于知识的有序储存和应用.下图A、B、C、D、E五种物质均含有同一种元素,它们之间有如图转化关系: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com