
����Ŀ��
��1���������й�������ȷ����( )
A������п�̵���У�MnO2�Ǵ���
B����пŦ�۵�ع���ʱ��Ag2O����ԭΪAg
C���ŵ�ʱ��Ǧ������������Ũ�Ȳ�������
D�����ʱ�����ƵĽ�����Ʒ���淢����ԭ��Ӧ
��2����п��һ��Ӧ�ù㷺�Ľ�����Ŀǰ��ҵ����Ҫ���á�ʪ��������ұ��п��ij��п�����Ҫ�ɷ�ΪZnS(��������FeS�������ɷ�)������Ϊԭ��ұ��п�Ĺ���������ͼ��ʾ��
�ش��������⣺
��п����ı������������յķ���¯�н��У���������ɰ����Ҫ�ɷֵĻ�ѧʽΪ��
��3�����չ����в����ĺ��������ɾ������ᣬ��������ں�����������
��4������Һ�������������м������Ҫ����Ϊ �� ����������
��5�������������е������������壬��������Pb-Ag�Ͻ���Ե缫�������ݳ���������
��6���Ľ���пұ�����գ������ˡ���ѹ�������ȫʪ�����̣���ʡ�������¿�����Ⱦ�ı��չ��̣��ֿɻ��һ���й�ҵ��ֵ�ķǽ������ʡ�����ѹ������з�����Ҫ��Ӧ�����ӷ���ʽΪ��
��7���ҹ��Ŵ������á�������ұ��п��������Ӧ�����ġ��칤������й��ڡ�������Ǧ���ļ��أ���¯��ʯʮ�װ����һ����ڣ�������Ȼ�������ú̿����ʢ�������н�������Ѻ죬������������ٹ�ȡ��������������ǦҲ��������п���չ�����Ҫ��Ӧ�Ļ�ѧ����ʽΪ��(ע��¯��ʯ����Ҫ�ɷ�Ϊ̼��п����Ǧ��ָ����п)
���𰸡�
��1��B��D
��2��ZnO
��3������
��4��п�ۣ��û���Fe��
��5��O2
��6��2ZnS+4H++O2=2Zn2++2S+2H2O
��7��ZnCO3+2C ![]() Zn+3CO����
Zn+3CO����
����������A������п�̵���У�MnO2��MnԪ�ػ��ϼ۽��ͣ�������ԭ��Ӧ������������A���������⣻
B����пŦ�۵�ع���ʱ��Ag2O������ԭ��Ӧ����Ag��B�������⣻
C��Ǧ�������ܵ�ط�ӦΪ��PbO2+2H2SO4+Pb ![]() 2PbSO4+2H2O����֪�ŵ�ʱǦ����������Ũ�Ȳ��ϼ�С��C���������⣻
2PbSO4+2H2O����֪�ŵ�ʱǦ����������Ũ�Ȳ��ϼ�С��C���������⣻
D�����ʱ���Ʋ��������ڶƼ��ŵ��γɶƲ㣬���ϼ۽��ͣ�������ԭ��Ӧ��D�������⣻
��2����п�����Ҫ�ɷ���ZnS�����������������������ԭ��Ӧ����ɰ����Ҫ�ɷ�ΪZnO��
��3���������ɵĺ����������ת��Ϊ���ᣬ���ں����Ľ���������
��4���ú�п���л�����FeS�����ʣ�����������ת��Ϊ�������ӣ��ɼ���п�۳�ȥ�������ӣ��Ӷ���ȥFe��
��5�������������У��ǵ��ZnSO4 �� ��������������Ӧ������ΪO2��
��6������ѹ�����������˼�壬��֪��Ӧ���к���H+��O2 �� ���Ի�÷ǽ�������S��д����ѧ����ʽΪ��2ZnS+4H++O2=2Zn2++2S��+2H2O��
��7��������Ŀ������֪��Ӧ��ΪZnCO3��C�����ﺬ��Zn����ѧ����ʽΪ��ZnCO3+2C ![]() Zn+3CO����
Zn+3CO����
�ʴ�Ϊ����1��BD����2��ZnO����3����������4��Zn�ۣ��û���Fe�ȣ���5��O2����6��2ZnS+4H++O2=2Zn2++2S��+2H2O����7��ZnCO3+2![]() Zn+3CO����1��A��п�̵���У�MnO2������ԭ��Ӧ��
Zn+3CO����1��A��п�̵���У�MnO2������ԭ��Ӧ��
B����пŦ�۵���У�������������ԭ��Ӧ�����������ʣ�
C��Ǧ���ط�Ӧ�����У��������
D����ƹ����У��Ʋ�����������ڶƼ��ϵõ��ӣ�
��.���չ����У�п���е�ZnS��FeS��������Ӧ������ZnO��Fe2O3����ϡ����������γ�����п����������Һ����ʱ�ټӹ���п�ۣ�����Һ�е����û��������ʣ��õ�����п��Һ�����е�⣬�Ӷ��õ�п���ʡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��ԭ������������������ֶ�����Ԫ�أ�B��Eͬ���壬��������������ϼ�+������ϼ�=0��A��C��D��C֮�䶼���γ�ԭ�Ӹ����ȷֱ�Ϊ2��1��1��1�����ֻ�����Խ�������й����⣮
��1����A2C 2�����к��еĻ�ѧ����______��______��
��2��C��D�γɵĻ�����ĵ���ʽΪ______��
��3��ʵ���ҿ�����B��C��D��ɵĻ�����Ϊ��Ӧ��֮һ��ȡ��A��C��D��ɵĻ������Ӧ�Ļ�ѧ����ʽΪ______��
��4��д��E������A��C��D�γɵĻ������ˮ��Һ��Ӧ�����ӷ���ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ����ʵ�鷽����ȷ����
A.����ˮ�����ѻ����ͺ�ֲ����B.��������Һ�����������ͼ�������
C.��̼�����Ƽ��𱽼���ͱ��״�D.��ˮ�������Ȼ�̼���屽
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������ͬ�ĵ��������ǣ�������
A.Ar��H2O2 �� C2H6B.CH4��Na+�� K+
C.SiH4��Al3+ �� Ca2+D.OH����S2�� �� NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���(SO2Cl2)��һ����Ҫ���л��ϳ��Լ���ʵ���ҿ�����SO2��Cl2��Ӧ��ȡ������SO2Cl2��װ����ͼ(��Щ֧��װ��ʡ����)��ʾ����֪SO2Cl2���۵�Ϊ-54.1�棬�е�Ϊ69.1�棻�����±Ƚ��ȶ��������ֽ⣬��ˮ�ܷ������ҵ�ˮ�ⷴӦ������֮һΪ�Ȼ������塣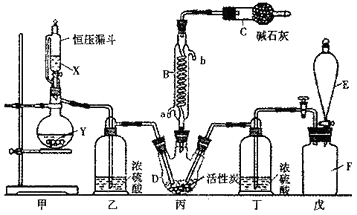
��1������E�������� �� ��B��ʹ�ÿ�֪SO2������֮��ķ�Ӧ����(��š�������)�ȷ�Ӧ��B����Ӧ����ȴˮӦ�� (�a����b��)�ӿ�ͨ�롣�������װ�÷����ˮ�У���������ڶ��Ȼ��������ɣ���ԭ������
��2���Լ�X��Y������������
a��98%�����ͭ b��ϡ������������ƹ��� c��60%�����������ع���
��3����������װ�ã���E�е��Լ�������ȱ��װ���ҺͶ�����ʪ�������Ͷ�������֮�䷢����Ӧ�Ļ�ѧ����ʽ�� ��
��4��ȡ1.00g������Һ�壬С�ĵ���ȫ����ˮ�������õ���Һ�м��������Ȼ�����Һ��������ɳ���������Ϊ1.50g������������ж��Ȼ����������ٷֺ���Ϊ %(�������С�����1λ)��
��5�����Ȼ���Ӧ���������������ͨ�����õĿⷿ�������ú��Ի�ɫ����ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��Xλ�ڵ������ڣ����̬ԭ�ӵ��ڲ���ȫ���������ӣ�������������Ϊ2��Ԫ��Y��̬ԭ�ӵ�3p�������4�����ӣ�X��Y�γɵĻ�����ľ�����ͼ��ʾ�����й��ڸþ����˵����ȷ���ǣ�������
A.1�����������ӵ�����Ϊ18
B.X2+���ӵ���λ��Ϊ8��Y2�����ӵ���λ��Ϊ4
C.��ÿ��X2+���������X2+����12��
D.�û�����Ļ�ѧʽΪCaS
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�����Һ����������������еĹ�ͬ������(����)
A����ɢ�ʿ���ֱ������1��100 nm֮��
B��������Ĥ
C��������ֽ
D���ʺ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ksp��AgCl��=1.8��10��10 �� Ksp��AgI��=1.5��10��16 �� Ksp��AgBr��=7.7��10��13 �� �����������εı�����Һ�У�Ag+Ũ�ȴ�С˳����ȷ���ǣ� ��
A.AgCl��AgI��AgBr
B.AgCl��AgBr��AgI
C.AgBr��AgCl��AgI
D.AgBr��AgI��AgCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ������С��36 ��X��Y��Z��W����Ԫ�أ�����X �γɵĵ�������������ʣ�Y ԭ�ӻ�̬ʱ���������������ڲ��������2 ����Zԭ�ӻ�̬ʱ2p ԭ�ӹ������3 ��δ�ɶԵĵ��ӣ�W ��ԭ������Ϊ29���ش��������⣺
��1��Y2X2 ��Yԭ�ӵ��ӻ�����Ϊ �� 1mol Y2X2 ���ЦҼ�����ĿΪ ��
��2��Y��һ����������Z ��һ�������ﻥΪ�ȵ����壬Z ���������������ʽ�� ��
��3����״��2.24L Z �ļ��⻯������Z ������������ˮ����ϡ��Һ������Q kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ ��
��4��Ԫ��W ��һ���Ȼ��ᄃ��ľ����ṹ��ͼ��ʾ�����Ȼ���Ļ�ѧʽ�� �� �Ȼ��ᄃ����������Z ������������ˮ�����Ũ��Һ��Ӧ�����ӷ���ʽΪ �� 
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com