
| A. | H2SO4是酸,因为H2SO4中含有氢元素 | |
| B. | 豆浆是胶体,因为其分散质粒子直径在>1nm | |
| C. | 分子、原子、电子、质子、沙子中,沙子不适宜用物质的量描述,因为其是微观微粒 | |
| D. | 氧化铝是碱性氧化物,因为铝是金属元素 |
分析 A.根据电离时生成的阳离子都是氢离子的化合物是酸;
B.根据胶体分散质粒子直径在1nm~100nm之间;
C.物质的量用来描述微观粒子;
D.金属氧化物不一定都是碱性氧化物.
解答 解:A.H2SO4是酸,因为H2SO4电离时生成的阳离子都是氢离子,故A错误;
B.豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间,故B错误;
C.物质的量用来描述微观粒子,沙子属于宏观粒子,不适宜用物质的量描述,故C正确;
D.金属氧化物不一定都是碱性氧化物,高锰酸酐Mn2O7就属于酸性氧化物,氧化铝属于两性氧化物,故D错误.
故选:C.
点评 本题主要考查了物质的分类、酸和氧化物的概念、胶体的概念等,难度不大,掌握分类的依据是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
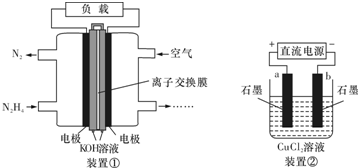
| A. | 该燃料电池负极发生的电极反应为:N2H4+4OH--4e-═N2+4H2O | |
| B. | 用该燃料电池作为装置②的直流电源,产生1molCl2至少需要通入0.5molN2H4 | |
| C. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 | |
| D. | 该燃料电池中,电子从右侧电极经过外电路流向左侧电极,溶液中OH-则迁移到左侧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
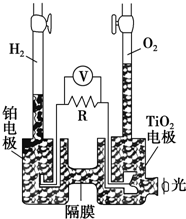 TiO2在光照射下可使水分解:2H2O $\frac{\underline{\;TiO_{2}\;}}{\;}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O $\frac{\underline{\;TiO_{2}\;}}{\;}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图.下列叙述正确的是( )| A. | 该装置可以将光能转化为电能,同时也能将其转化为化学能 | |
| B. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸酐一定是氧化物 | |
| B. | 酸性氧化物一定是非金属氧化物 | |
| C. | 碱性氧化物一定是金属氧化物 | |
| D. | 正四面体分子中键角一定是109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2 | B. | CH2=CHCH=CH2 | C. | CH≡C-CH3 | D. | CH≡C-CH2-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -10+3n | B. | -6+3n | C. | -(12-3n) | D. | -(4-2n) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于5 s | B. | 大于5 s | C. | 等于10 s | D. | 小于5 s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com