
【题目】下列各组物质中,按单质、化合物、混合物的顺序排列正确的是( )
A.生石灰、熟石灰、冰水混合物B.氮气、浓硫酸、胆矾
C.干冰 、铁、氯化氢D.水银、水蒸气、空气
科目:高中化学 来源: 题型:
【题目】煤燃烧产生的烟气含有的SO2,是大气主要污染物之一。减少煤燃烧对大气造成的污染,应从多方面采取措施。
(1)在煤燃烧前需对煤进行脱硫处理。
①一种烟气脱硫技术是向煤中加入适量石灰石,可大大减少燃烧产物中SO2的含量,最后生成CaSO4,该反应的化学方程式为_________________________________________。
②煤炭中以FeS2(铁元素为+2价)形式存在的硫,可以采用微生物脱硫技术脱去,其原理如图所示:
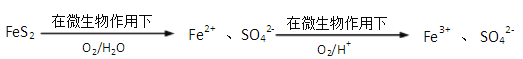
1mol FeS2完全转化为Fe3+ 和SO42-时,FeS2与O2物质的量之比为_____________。
(2)燃煤后烟气脱硫方法之一是利用天然海水的碱性吸收烟气中SO2并转化为无害的SO42-,其流程的示意图如下:
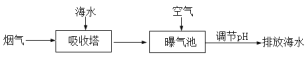
①海水中碳元素主要以HCO3-的形式存在。用离子方程式表示海水呈碱性的原因:_____________。
②研究表明,进入吸收塔的海水温度越低,SO2的脱除效果越好,主要原因是_____________。
③从吸收塔排出的海水呈酸性,并含有较多的HSO3-,排入曝气池进行处理时,需要鼓入大量空气。空气的作用是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于银镜反应的实验操作步骤如下:
A.在试管中先注入少量NaOH溶液,振荡,加热煮沸之后把NaOH溶液倒去,再用蒸馏水洗净试管备用
B.在洗净的试管里配制银氨溶液
C.向银氨溶液中滴入3~4滴乙醛稀溶液
D.加热
请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目的是_____________________________;
(2)简述银氨溶液的配制过程:__________________________________________;
(3)写出乙醛发生银镜反应的化学方程式:_____________________________________;
(4)银氨溶液久置可能会爆炸,直接排放会污染环境,且造成资源浪费,实验室从废液中回收银的实验流程如下:![]()
已知:[Ag(NH3)2]+![]() Ag++2NH3
Ag++2NH3
①写出废液与稀硝酸反应的离子方程式:__________________________________;
②加入铁粉要过量的目的是___________________________________________.
③该实验过程中可能产生的大气污染物是________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A 是农药生产中的一种中间体,结构简式如下图所示。下列叙述中正确的是
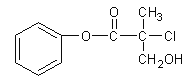
A.1mol A最多能与4mol H2发生加成反应
B.有机物A可以在一定条件下与HBr发生反应
C.有机物A与浓硫酸混合加热,可以发生消去反应
D.1mol A与足量的NaOH溶液反应,最多可以消耗2mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存并且溶液为无色透明的离子组是
A.Ca2+、Na+、NO3-、CO32-B.Mg2+、Cl-、 NH4+、SO42-
C.K+、Cl-、HCO3-、NO3-D.Ca2+、Na、 Fe3+、 NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学要以“研究苯分子的结构”为题目做一次探究活动,下面是其活动记录,请你补全所缺内容。
(1)理论推测:他根据苯的凯库勒式________,推测苯分子中有两种不同的碳碳键,即________和________,因此它能使紫色的________溶液褪色。
(2)实验验证:他取少量的上述溶液加入试管中,然后加入苯,充分振荡,发现_____________________。
(3)实验结论:上述的理论推测是________(填“正确”或“错误”)的。
(4)查询资料:经查阅有关资料,发现苯分子中六个碳原子之间的键________(填“相同”或“不同”),是一种特殊的键,苯分子中的六个碳原子和六个氢原子________(填“在”或“不在”)同一个平面上,应该用________表示苯分子的结构更合理。
(5)发现问题:当他将苯加入溴水中时,充分振荡,发现能使溴水褪色,于是该同学认为所查资料有误。你同意他的结论吗?____。为什么?______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大。A元素原子最外层电子数是次外层电子数的2倍,B元素原子最外层电子数等于其电子层数,且为C元素原子最外层电子数的一半。甲为含B的钠盐,乙为C的最高价氧化物对应的水化物,丙为含A的钠盐。 甲、乙、丙、丁四种物质之间的相互反应关系如下图:
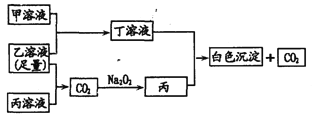
请回答:
(1)写出Na2O2的电子式___________;C在周期表中的位置____________。
(2)用有关化学用语解释丙溶液呈碱性的原因___________________________。
(3)写出甲溶液与足量乙溶液反应的离子方程式: ________________________。
(4)丙和丁因发生双水解而不能共存写出该反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料,某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
(方案1)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
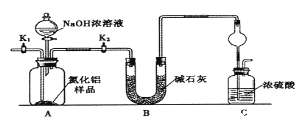
(1)如图C装置中球形干燥管的作用是______________。
(2)完成以下实验步骤:组装好实验装置,首先______;再加入实验药品。接下来的实验操作是____,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见_________。
(方案2)用如下图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
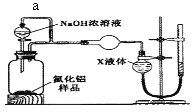
(4)导管a的主要作用是______________。
(5)为测定生成气体的体积,量气装置中的X液体可以是____________。(填选项序号)
a.CCl4 b.H2O c.NH4Cl溶液 d.![]()
(6)若mg样品完全反应,测得生成气体的体积为VmL,(已转换为标准状况),则A1N的质量分数为___(用含V、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 同温同压下H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件的ΔH都相同
B. 已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为-241.8kJ/mol
C. 在稀溶液中H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 molH2SO4的浓硫酸与含1 molNaOH的稀溶液混合,放出的热量为57.3 kJ
D. 由N2O4(g) ![]() 2NO2(g) △H=-56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
2NO2(g) △H=-56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com