
| A. | 分别对两溶液微热时,K均增大、溶液pH均减小 | |
| B. | 恒温下分别稀释两溶液时,K均不变、溶液pH均增大 | |
| C. | 25℃时a+b=14 | |
| D. | 25℃时两溶液混合所得pH=8的溶液中,c(X-)>c(Na+) |
分析 A、HX的电离和X-的水解都是吸热反应,升温平衡正向移动;
B、加水稀释溶液,溶液酸碱性减弱;
C、Kw只受温度影响,HX的电离平衡常数和X-的水解平衡常数乘积等于Kw;
D、25℃时pH=8的溶液显碱性,据电荷守恒分析.
解答 解:A、升温HX的酸性增强,pH减小,NaX溶液的碱性增强,pH增大,故A错误;
B、加水稀释,HX的酸性减弱,pH增大,NaX溶液的碱性减弱,pH减小,故B错误;
C、HX的电离平衡常数和X-的水解平衡常数乘积等于Kw,所以25℃a+b=14,故C正确;
D、25℃时pH=8的溶液显碱性,溶液中c(Na+)>c(X-)>c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查了弱酸的电离平衡和弱酸根离子的水解平衡移动的影响因素以及离子浓度大小的比较,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
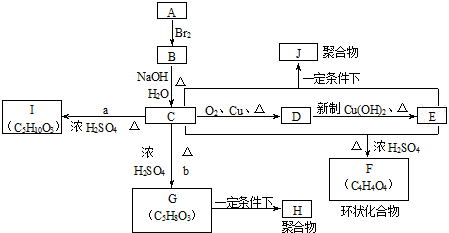
 ;指出C→G的反应类型酯化(取代)反应.
;指出C→G的反应类型酯化(取代)反应.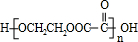 +(2n-1)H2O
+(2n-1)H2O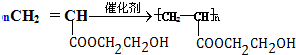
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
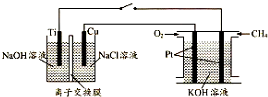
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中由水电离的氢离子浓度为10-4 | |
| B. | 与pH=4的盐酸等体积混合后,c(Cl-)>c(NH4+) | |
| C. | 通入一定量氨气后,依然存在c(NH4+)+c(H+)=c(OH-) | |
| D. | 氨水中存在:c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
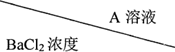 | 0.2mol/L | 0.1mol/L | 0.02mol/L |
| 0.2mol/L | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol/L | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol/L | 少许浑浊 | 无现象 | 无现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加入适量铜粉的方法除去Cu(NO3)2溶液中混有的AgNO3 | |
| B. | 用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 | |
| C. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液的SO42- | |
| D. | 先后添加酚酞试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将铁片置于浓硝酸中:Fe+6HNO3(浓)═Fe(NO3)3+3NO2↑+3H2O | |
| B. | 向氯化铵的稀溶液中加入少量NaOH:NH4++OH-═NH3↑+H2O | |
| C. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-═BaSO4↓ | |
| D. | 向浓硝酸中加入铜片:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com