
.化学在日常生活和生产中有着重要的应用。下列说法不正确的是
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.纯二氧化硅大量用于制造光导纤维
C.Al2O3的熔点很高,可用于制作耐高温材料
D.电解MgCl2饱和溶液,可制得金属镁
 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
已知A、B、C、D、E为周期表里1~20号元素中的五种。又知:①A与D同族,且A、D为非金属元素,B与E同族,B与C同周期;②E的原子序数为奇数,A与E的原子序数之和为28;③0.1mol C单质与足量的E的最高价氧化物对应水化物的溶液反应生成3.36 L(标准状况)的氢气。请回答下列问题:
(1)C的单质与足量的E的最高价氧化物对应的水化物的溶液反应的离子方程式 。
(2)B单质的最高价氧化物的水化物与D的最高价氧化物水化物之间相互反应生0.9 g水时,放出的热量为Q kJ,请写出该反应的热化学方程式 。
(3)请用电子式表示D元素和E元素所构成的化合物的形成过程 。
(4)向⑴所得的溶液中通入过量的CO2气体,过滤后的滤液(不考虑过量二氧化碳的溶解)中各种粒子的数量的从大到小的排序为 。
(5)C单质在日常生活和工业、农业、军事、科技等领域有广泛应用。如在海水中用碳棒和C单质做电极构成原电池,该原电池的正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E为周期表里1~20号元素中的五种。又知:①A与D同族,且A、D为非金属元素,B与E同族,B与C同周期;②E的原子序数为奇数,A与E的原子序数之和为28;③0.1mol C单质与足量的E的最高价氧化物对应水化物的溶液反应生成3.36 L(标准状况)的氢气。请回答下列问题:
(1)C的单质与足量的E的最高价氧化物对应的水化物的溶液反应的离子方程式 。
(2)B单质的最高价氧化物的水化物与D的最高价氧化物水化物之间相互反应生0.9 g水时,放出的热量为Q kJ,请写出该反应的热化学方程式 。
(3)请用电子式表示D元素和E元素所构成的化合物的形成过程 。
(4)向⑴所得的溶液中通入过量的CO2气体,过滤后的滤液(不考虑过量二氧化碳的溶解)中各种粒子的数量的从大到小的排序为 。
(5)C单质在日常生活和工业、农业、军事、科技等领域有广泛应用。如在海水中用碳棒和C单质做电极构成原电池,该原电池的正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2011届河北省唐山一中高三第二次调研考试理综化学部分 题型:填空题
已知A、B、C、D、E为周期表里1~20号元素中的五种。又知:①A与D同族,且A、D为非金属元素,B与E同族,B与C同周期;②E的原子序数为奇数,A与E的原子序数之和为28;③0.1mol C单质与足量的E的最高价氧化物对应水化物的溶液反应生成3.36 L(标准状况)的氢气。请回答下列问题:
(1)C的单质与足量的E的最高价氧化物对应的水化物的溶液反应的离子方程式 。
(2)B单质的最高价氧化物的水化物与D的最高价氧化物水化物之间相互反应生0.9 g水时,放出的热量为Q kJ,请写出该反应的热化学方程式 。
(3)请用电子式表示D元素和E元素所构成的化合物的形成过程  。
。
(4)向⑴所得的溶液中通入过量的CO2气体,过滤后的滤液(不考虑过量二氧化碳的溶解)中各种粒子的数量的从大到小的排序为 。
(5)C单质在日常生活和工业、农业、军事、科技等领域有广泛应用。如在海水中用碳棒和C单质做电极构成原电池,该原电池的正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年重庆市高三考前模拟测试理科综合试题化学试卷(解析版) 题型:填空题
(15分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途,请回答下列问题:
(1)铁元素在周期表中的位置是 。
(2)写出Fe与稀硫酸反应的离子方程式 。
(3)已知:Fe2O3(s)+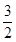 C(s)=
C(s)=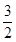 CO2(g)+2Fe(s);△H=+234.1kJ/mol
CO2(g)+2Fe(s);△H=+234.1kJ/mol
C(s)+O2(g)=CO2(g); △H=-393.5kJ/mol.
请写出Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式 。
(4)在一定条件下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)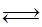 2Fe(s)+3CO2(g);工业上有16 t Fe2O3在200m3的容器中反应,l小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为 mol/(L·h).
2Fe(s)+3CO2(g);工业上有16 t Fe2O3在200m3的容器中反应,l小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为 mol/(L·h).
(5)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2;高铁酸钠( Na2FeO4)是一种新型饮水消毒剂.用题29图装置可以制取少量高铁酸钠.
Fe(OH)2+Ni(OH)2;高铁酸钠( Na2FeO4)是一种新型饮水消毒剂.用题29图装置可以制取少量高铁酸钠.
①此装置中爱迪生蓄电池的负极是____(填“a”或"b”).
②写出阳极的电极反应式________.
③当制得132.8g高铁酸钠时,阳极区减少的阴离子的物质的量为 .

查看答案和解析>>
科目:高中化学 来源:2010-2011学年河北省高三第二次调研考试理综化学部分 题型:填空题
已知A、B、C、D、E为周期表里1~20号元素中的五种。又知:①A与D同族,且A、D为非金属元素,B与E同族,B与C同周期;②E的原子序数为奇数,A与E的原子序数之和为28;③0.1mol C单质与足量的E的最高价氧化物对应水化物的溶液反应生成3.36 L(标准状况)的氢气。请回答下列问题:
(1)C的单质与足量的E的最高价氧化物对应的水化物的溶液反应的离子方程式 。
(2)B单质的最高价氧化物的水化物与D的最高价氧化物水化物之间相互反应生0.9 g水时,放出的热量为Q kJ,请写出该反应的热化学方程式 。
(3)请用电子式表示D元素和E元素所构成的化合物的形成过程 。
(4)向⑴所得的溶液中通入过量的CO2气体,过滤后的滤液(不考虑过量二氧化碳的溶解)中各种粒子的数量的从大到小的排序为 。
(5)C单质在日常生活和工业、农业、军事、科技等领域有广泛应用。如在海水中用碳棒和C单质做电极构成原电池,该原电池的正极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com