
【题目】下列图示与对应的叙述相符的是

A.图1表示盐酸滴加到0.1 mol·L-1某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂。
B.图2表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂。
C.图3表示工业上用CO生产甲醇的反应CO(g)+2H2(g)![]() CH3OH(g),该反应的ΔH=-91kJ/mol。
CH3OH(g),该反应的ΔH=-91kJ/mol。
D.图4表示物质的量之比为2∶3的镁和铝分别与过量稀硫酸反应时,产生气体的体积(V)与时间(t)的关系。
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)![]() 2NO2(g) △H>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示:
2NO2(g) △H>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示:
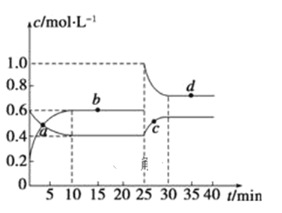
(1)该温度下,若温度升高,K值将___________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是_____点。
(3)25 min时,加入了___________填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度_____(填“大于”、“小于”或“等于”)0.8 mol/L,理由是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
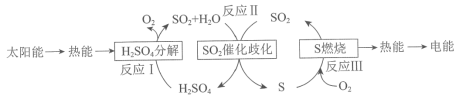
反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有“退热冰”之称的乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,纯乙酰苯胺是一种白色有光泽片状结晶,不仅本身是重要的药物,而且是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。实验室用苯胺与乙酸合成乙酰苯胺的反应和实验装置如图(夹持及加热装置略):
![]() +CH3COOH
+CH3COOH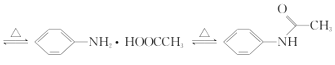 +H2O
+H2O
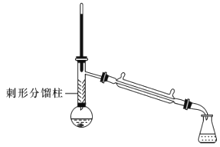
注:①苯胺与乙酸的反应速率较慢,且反应是可逆的。
②苯胺易氧化,加入少量锌粉,防止苯胺在反应过程中氧化。
③刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。
可能用到的有关性质如下:(密度单位为g/cm3)
名称 | 相对分子质量 | 性状 | 密度/gcm3 | 熔点/℃ | 沸点/ | 溶解度 | |
g/100g水 | g/100g乙醇 | ||||||
苯胺 | 93.12 | 棕黄色油状液体 | 1.02 | -6.3 | 184 | 微溶 | ∞ |
冰醋酸 | 60.052 | 无色透明液体 | 1.05 | 16.6 | 117.9 | ∞ | ∞ |
乙酰苯胺 | 135.16 | 无色片状晶体 | 1.21 | 155~156 | 280~290 | 温度高,溶解度大 | 较水中大 |
合成步骤:
在50mL圆底烧瓶中加入10mL新蒸馏过的苯胺和15mL冰乙酸(过量)及少许锌粉(约0.1g)。用刺形分馏柱组装好分馏装置,小火加热10min后再升高加热温度,使蒸气温度在一定范围内浮动1小时。在搅拌下趁热快速将反应物以细流倒入100mL冷水中冷却。待乙酰苯胺晶体完全析出时,用布氏漏斗抽气过滤,洗涤,以除去残留酸液,抽干,即得粗乙酰苯胺。
分离提纯:
将粗乙酰苯胺溶于300mL热水中,加热至沸腾。放置数分钟后,加入约0.5g粉未状活性炭,用玻璃棒搅拌并煮沸10min,然后进行热过滤,结晶,抽滤,晾干,称量并计算产率。
(1)由于冰醋酸具有强烈刺激性,实验中要在__内取用,加入过量冰醋酸的目的是__。
(2)反应开始时要小火加热10min是为了__。
(3)实验中使用刺形分馏柱能较好地提高乙酰苯胺产率,试从化学平衡的角度分析其原因:__。
(4)反应中加热方式可采用__(填“水浴”“油浴”或"直接加热”),蒸气温度的最佳范围是__(填字母代号)。
a.100~105℃ b.117.9~184℃ c.280~290℃
(5)判断反应基本完全的现象是__,洗涤乙酰苯胺粗品最合适的试剂是__(填字母代号)。
a.用少量热水洗 b.用少量冷水洗
c.先用冷水洗,再用热水洗 d.用酒精洗
(6)分离提纯乙酰苯胺时,在加入活性炭脱色前需放置数分钟,使热溶液稍冷却,其目的是__,若加入过多的活性炭,使乙酰苯胺的产率__(填“偏大”“偏小”或“无影响”)。
(7)该实验最终得到纯品7.36g,则乙酰苯胺的产率是__%(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究卤代烃的化学性质,某化学课外小组的学生进行了如下实验。
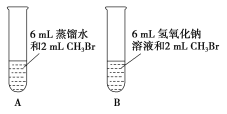
(1)甲同学设计了A、B两个实验,充分振荡反应后,甲先从试管A的水层中取出少量溶液,滴入盛装有硝酸酸化的硝酸银溶液的试管中,观察到的实验现象是____;后从试管B(NaOH溶液的浓度是0.5 mol·L-1)的水层中取出少许溶液,滴入盛有足量硝酸酸化的硝酸银溶液的试管中,观察到的实验现象是____,写出该反应的化学方程式:____。A、B两个实验说明____。
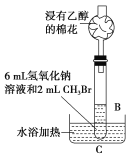
(2)乙同学在B的基础上设计装置C,研究氢氧化钠溶液和CH3Br的反应。浸有乙醇的棉花的作用是____,有人认为,控制装置C中水浴温度是本实验的关键,则应控制水浴温度低于____的沸点。
(3)丙同学将NaOH溶液的浓度从0.5 mol·L-1增大到1.0 mol·L-1、1.5 mol·L-1,经过相同的时间(试管中还有油滴)后从试管B的水层中取出少许溶液,滴入盛有足量硝酸酸化的硝酸银溶液的试管中,发现生成沉淀的质量依次增大,该现象说明____,还可以通过其他实验操作说明该结论,简述另一种实验思想:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镍可用于制作发光器件、半导体激光器、太阳能电池和高速集成电路。
(1)基态Ni原子的价电子排布式为 ___,基态As原子电子占据最高能级的电子云轮廓图为 __ 形。
(2)第一电离能As ___Se(填“>”或“<”) ,原因是____。As2O3(砒霜)是两性氧化物,As2O3溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AsH3。
(3)①AlH4-的中心原子的杂化方式为___,其空间构型为____,写出一种与AlH4-互为等电子体的分子的化学式___。
②AsH3分子中H—As—H键角__109.5°(填“>”、“=”或“<”)。AsH3沸点低于NH3,其原因是____。
(4)有机砷![]() 是治疗昏睡病不可缺少的药物,该有机砷中存在的化学键的种类为____(填字母编号)。
是治疗昏睡病不可缺少的药物,该有机砷中存在的化学键的种类为____(填字母编号)。
a.离子键 b.σ键 c.π键 d.碳碳双键
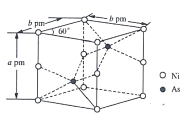
(5)砷化镍激光在医学上用于治疗皮肤及粘膜创面的感染、溃疡等,砷化镍晶胞如图所示,该晶胞密度ρ为____g·cm-3(列式即可,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH- ΔH>0,下列叙述正确的是( )
H++OH- ΔH>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H﹢)增大,Kw不变
C.向水中通入少量HCl气体,平衡正向移动,c(H﹢)增大
D.将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图是甲烷燃料电池原理示意图,回答下列问题:
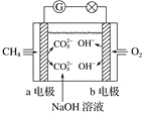
①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为__________________。
②电池工作一段时间后电解质溶液的pH________(填“增大”、“减小”或“不变”)。
(2)熔融盐燃料电池具有很高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池。请完成有关的电池反应式:
负极反应式:2CO+2![]() -4e-===4CO2;
-4e-===4CO2;
正极反应式:__________________________________________;
总电池反应式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化工厂对海水资源综合利用的示意图。根据以上信息,判断下列相关分析不正确的是
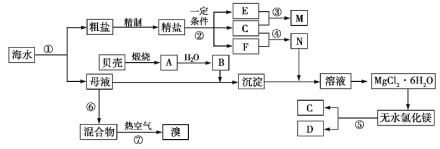
A. 上述提取Mg的流程中,没有涉及的反应类型是置换反应
B. 因氮气的化学性质相对稳定,冷却电解无水氯化镁所得的镁蒸气时,可选择氮气
C. 反应⑥所用的气态氧化剂可从本厂生产烧碱处循环利用或从本厂生产镁单质处循环利用
D. 从母液中提取Mg和Br2的先后顺序:先提取Br2,后提取Mg
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com