
| A、T℃时,测得某NaNO2溶液的pH=8,则溶液中c(Na+)-c(NO2-)=9.9×10-7mol?L-1 | ||||||||
| B、已知25℃时,有关弱电解质的电离平衡常数:HCN:Ka=4.9×10-10;H2CO3:Ka1=4.3×10-8,Ka2=5.6×10-11.则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2=2HCN+Na2CO3 | ||||||||
C、一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如下数据:
| ||||||||
| D、已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 |
| 0.001mol/L |
| 0.1mol/L |


科目:高中化学 来源: 题型:
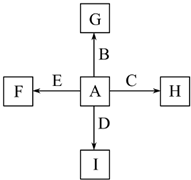 图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:| 高温 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、往酸性KMnO4溶液中通入SO2验证SO2的还原性 |
| B、加热氯化铵与氢氧化钙固体混合物制取氨气 |
| C、用二氧化锰和稀盐酸反应制取氯气 |
| D、在溴水、碘水中加入四氯化碳以萃取其中的溴、碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、充电时,阳极附近溶液由蓝色逐渐变为黄色 |
| B、放电过程中,正极附近溶液的酸性减弱 |
| C、充电时,反应每生成2mol H+时电子转移数为2mol |
| D、放电时,负极反应为V2+-e-=V3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极电极反应式为:Pb-2e-=Pb2+ |
| B、充电时阴极电极反应式为:PbSO4+2e-=Pb+SO42- |
| C、充电时,若要使1mol PbSO4转变为Pb和PbO2,则需要通过4mol电子 |
| D、放电时,H+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、F | B、Cl | C、Li | D、Na |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成B的速率与C分解的速率相等 |
| B、A、B、C的浓度相等 |
| C、单位时间生成 n mol A,同时生成 2n mol C |
| D、A、B、C的分子数之比为 1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、白磷和红磷 |
| B、23Na和22Na |
| C、葡萄糖和蔗糖 |
| D、CH3CH(CH3)CH3和CH3CH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液可能由0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成 |
| B、该溶液可以由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成 |
| C、该溶液中离子浓度的关系符合c(CH3COO-)+c(OH-)>c(Na+)+c(H+) |
| D、在上述溶液中加入适量NaOH,离子浓度大小可改变为:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com