
| A. | C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) (△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)(△H=+57.3 kJ/mol (中和热) | |
| C. | S(s)+O2(g)=SO2(g) (△H=-269.8 kJ/mol (反应热) | |
| D. | 2NO2=O2+2NO (△H=+116.2 kJ/mol (反应热) |
分析 A.燃烧热中生成水为液态;
B.中和为放热反应;
C.燃烧为放热反应;
D.热化学方程式中应注明物质的状态.
解答 解:A.燃烧热方程式应为C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(l)△H=-1367.0 kJ/mol,故A错误;
B.中和热方程式应为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△H=-57.3 kJ/mol,故B错误;
C.热化学方程式为S(s)+O2(g)=SO2(g)△H=-269.8 kJ/mol,表示合理,故C正确;
D.热化学方程式应为2NO2(g)=O2(g)+2NO(g)△H=+116.2 kJ/mol,故D错误;
故选C.
点评 本题考查热化学方程式的书写,为高频考点,把握反应中能量变化、热化学方程式的书写方法、燃烧热与中和热为解答的关键,侧重分析与应用能力的考查,注意物质的状态、焓变的正负,题目难度不大.


科目:高中化学 来源:2016-2017学年四川省高二上教学质检化学试卷(解析版) 题型:选择题
下列表达方式错误的是
A. D2O分子中氧原子为sp3杂化
B. Cr原子价电子排布式:3d54s1
C. 硫离子的核外电子排布式:1s22s22p63s23p6
D. S原子的电子排布图: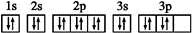
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
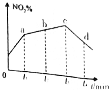 研究氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应:
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学家哈伯用催化法合成氨后,就能生产硝酸铵 | |
| B. | 化学家合成碳纳米管,用作分子导线和超小型电子器件 | |
| C. | 俄国科学家门捷列夫发现元素周期律 | |
| D. | 诺贝尔用硝化甘油制成了炸药,并用于工业生产 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 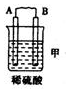 | 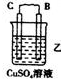 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L | |
| B. | 1 mol臭氧和1.5 mol氧气含有相同的氧原子数 | |
| C. | 标准状况下,22.4 L H2O的分子数为1NA | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列说法正确的是( )
下列说法正确的是( )| A. | FeO、Fe2O3和Fe3O4均为黑色固体 | |
| B. | 反应②③互为可逆反应 | |
| C. | 热稳定性顺序为:FeO>Fe2O3>Fe3O4 | |
| D. | 四氧化三铁中铁元素的化合价复杂,若写成氧化物的形式则化学式可写为FeO•Fe2O3,若视四氧化三铁为一种盐其化学式可写为Fe(FeO2)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:HClO4>H2SO4>H3PO4>H2SiO3 | |
| B. | 原子半径大小:K>Na>S>O | |
| C. | 稳定性:NH3>PH3>AsH3 | |
| D. | 还原性强弱:F->Cl->Br |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com