
| A、Fe3O4与足量稀HNO3反应:Fe3O4+8H+═2Fe3++Fe2++4H2O |
| B、玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-═NaSiO3↓+H2O |
| C、向双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O |
| D、往碳酸氢钙溶液中滴入少量氢氧化钠溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
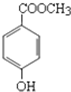 尼泊金酯是一种高效食品防腐剂,其结构简式为:
尼泊金酯是一种高效食品防腐剂,其结构简式为:查看答案和解析>>
科目:高中化学 来源: 题型:

| 化学键 | ①-① | ①-④ | ④-④ | ④=④ | ④≡④ |
| 键能/kJ?mol-1 | 436.0 | 390.8 | 193 | 418 | 946 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学反应的快慢和限度对人类生产生活有重要的意义.
化学反应的快慢和限度对人类生产生活有重要的意义.| 实例 | 影响条件 |
| ①食物放在冰箱里能延长保质期 | 温度(示例) |
| ②实验室将块状药品研细,再进行反应 | |
| ③用H2O2分解制O2时,加入MnO2 | |
| ④工业制硫酸催化氧化SO2制取SO3时,通入过量的空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜和硝酸银反应:Cu+Ag+═Cu2++Ag | ||||
| B、NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | ||||
| C、稀HNO3中加入少量铁粉:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | ||||
D、NH4Cl和NaOH的两浓溶液混合加热:NH4++OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯 |
| B、邻甲基苯酚、乙醇、苯甲酸在一定条件下均可以和金属钠反应放出氢气 |
| C、含醛基的化合物在发生化学反应时既可以被氧化又可以被还原 |
| D、甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com