
 有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,C及其合金是人类最早使用的金属材料.D与A位于同一主族,是构成地球上矿物质的主要元素.请回答下列问题:
有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,C及其合金是人类最早使用的金属材料.D与A位于同一主族,是构成地球上矿物质的主要元素.请回答下列问题:分析 有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,则A为C元素;由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,则B为Br元素;C及其合金是人类最早使用的金属材料,则C为Cu元素;D与A位于同一主族,是构成地球上矿物质的主要元素,则D为Si元素;
(1)A与D所形成的化合物属于碳化硅,原子之间是通过共价键作用形成空间网状结构;根据价层电子对互斥理论确定中心原子杂化类型;
(2)Br是35号元素,根据构造原理书写其基态原子核外电子排布式;
(3)硫酸铜溶液中加氨水先生成沉淀,氨水过量,沉淀溶解,生成络离子;加乙醇降低晶体的溶解度;
(4)组成与结构相似的分子,相对分子质量越大,分子间的作用力越大,熔点越高;
(5)a.溶解度小的先析出晶体;
b.钾型是非密置层堆积方式;
c.采用沿X、Y、Z三轴切割的方法判断二氧化碳分子的个数.
d.能形成分子间氢键的物质沸点较高;能形成分子内氢键的物质沸点较低;
(6)利用均摊法计算;先求出此晶胞含有原子数,然后根据ρ=$\frac{m}{V}$计算出密度;
解答 解:经过分析可知:A为C元素,B为Br元素,C为Cu元素;D为Si元素;
(1)碳化硅原子之间是通过共价键作用形成空间网状结构,属于原子晶体;碳化硅中的硅原与四个邻近碳原子生成4个共价键,形成4个σ键,无孤电子对,碳原与四个邻近硅原子生成4个共价键,形成4个σ键,无孤电子对,所以中心原子采取sp3杂化;
故答案为:原子;sp3;
(2)Br是35号元素,其基态原子核外电子排布式为:[Ar]3d104s24p5;
故答案为:[Ar]3d104s24p5;
(3)铜离子和氨水先生成氢氧化铜沉淀,离子方程式为:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+,氢氧化铜能溶于氨水生成铜氨络合离子,离子方程式为:Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-,则观察到的现象为先生成蓝色沉淀,后沉淀溶解得到深蓝色的透明溶液;铜氨络合物在水中的溶解性大于在乙醇中的溶解性,析出铜氨络合物,所以向溶液中加入乙醇,析出深蓝色的晶体为Cu(NH3)4SO4•H2O;
故答案为:先生成蓝色沉淀,后沉淀溶解得到深蓝色的透明溶液;Cu(NH3)4SO4•H2O;铜氨络合物在水中的溶解性大于在乙醇中的溶解性,析出铜氨络合物;
(4)CH4与SiH4是组成与结构相似的物质,CH4比SiH4的相对分子质量要小,分子间的作用力要小,所以熔点要低;
故答案为:SiH4;CH4与SiH4是组成与结构相似的物质,CH4比SiH4的相对分子质量要小,分子间的作用力要小,所以熔点要低;
(5)a.溶解度小的先析出晶体,与晶格能的大小无关,故a错误;
b.钾型的空间利用率为68%是非密置层堆积方式,铜型的空间利用率是72%是密置层堆积方式,故b错误;
c.采用沿X、Y、Z三轴切割的方法判断二氧化碳分子的个数为12,所以在CO2晶体中,与每个CO2分子周围紧邻的有12个CO2分子,故c正确;
d.邻羟基苯甲醛容易形成分子内氢键,对羟基苯甲醛易形成分子间氢键,所以邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点低,故d错误;
故选c.
(6)利用均摊法计算可知,晶胞中Ca位于定点,N(Ca)=8×$\frac{1}{8}$=1,Cu位于面心和体心,共有N(Cu)=8×$\frac{1}{2}$+1=5,则该合金中Ca和Cu的原子个数比为1:5;一个晶胞中含有1个Ca原子,5个Cu原子360,则一个晶胞的质量m=$\frac{360}{{N}_{A}}$g,一个晶胞的体积V=(a×10-10cm)3,因此晶胞的密度ρ=$\frac{m}{V}$=$\frac{360}{{N}_{A}(a×1{0}^{-10}){\;}^{3}}$g/cm3,
故答案为:1:5;$\frac{360}{{N}_{A}(a×1{0}^{-10}){\;}^{3}}$;
点评 本题考查核外电子排布、分子空间构型、杂化类型的判断、熔点比较、晶体的计算,但解题具有较强的方法性和规律性,学习中注意总结如何判断分子空间构型以及有关晶体计算等方法.


科目:高中化学 来源: 题型:选择题
| A. | X分别和其它四种元素均可形成至少2种化合物 | |
| B. | M分别和w、X、Y、Z形成化合物,均显相同化合价 | |
| C. | M、X、Z三种元素组成的化合物含有离子键 | |
| D. | M、X、Y组成化合物和Y、Z组成化合物,它们所含的化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
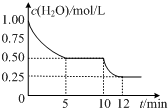 在2L密闭容器中进行反应C (s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确的是( )
在2L密闭容器中进行反应C (s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确的是( )| A. | 0~5min内,v (H2)=0.05mol/(L•min) | |
| B. | 5min时该反应的K值一定小于12 min时的K值 | |
| C. | 10 min时,改变的外界条件可能是减小压强 | |
| D. | 5min时该反应的v (正)大于11 min 时的v (逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
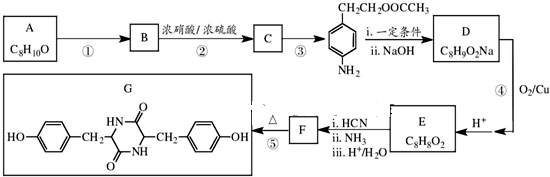
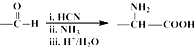 ,NO2$\stackrel{Fe?HCl}{→}$NH2
,NO2$\stackrel{Fe?HCl}{→}$NH2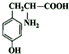 .
.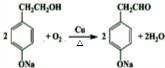 .
.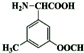 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
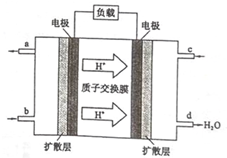 乙醇是一种常用的燃料,也可用于燃料电池.该燃料电池的工作原理如图所示.
乙醇是一种常用的燃料,也可用于燃料电池.该燃料电池的工作原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.1% | B. | 72.6% | C. | 84.7% | D. | 6.05% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
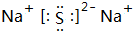 ,D原子的质子数和中子数相等,D的原子组成符号为1632 S.
,D原子的质子数和中子数相等,D的原子组成符号为1632 S.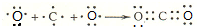 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com