
下列结论错误的是
A.氢化物的稳定性:HF>HCl>H2S>PH3>SiH4 B.微粒半径:K+>Al3+>S2->Cl—
C.酸性:H2SO4>CH3COOH>H2CO3>HClO D.金属性:K>Ca>Mg>Be
科目:高中化学 来源:2013-2014甘肃省下学期期中考试高一化学试卷(解析版) 题型:选择题
石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石。已知12 g石墨完全转化成金刚石时,要吸收1.9 kJ的能量。下列说法正确的是( )
A.石墨不如金刚石稳定
B.由金刚石制备石墨是吸热反应
C.等质量的石墨与金刚石完全燃烧,金刚石放出的能量更多
D.等质量的石墨与金刚石完全燃烧,石墨放出的能量更多
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃兰州一中高二下学期期末考试化学试卷(解析版) 题型:选择题
下列依据相关数据作出的推理和判断中,不正确的是
A.依据相对分子质量的数据,推测乙醇和丙烷沸点的相对高低
B.依据溶解度的数据,选择用重结晶的方法可将粗苯甲酸提纯
C.依据沸点的数据,判断用分馏的方法从石油中获取汽油和煤油等
D.依据燃烧热的数据、热化学方程式和盖斯定律,可计算一些反应的反应热
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃兰州一中高一下学期期末考试化学试卷(解析版) 题型:选择题
分析下表中各项的排布规律,按此规律排布第26项应为
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
C2H4 | C2H6 | C2H6O | C2H4O2 | C3H6 | C3H8 | C3H8O | C3H6O2 | C4H8 | C4H10 |
A.C7H16 B.C7H14O2 C.C8H18 D.C8H18O
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃兰州一中高一下学期期末考试化学试卷(解析版) 题型:选择题
为提纯下列物质(括号内为杂质).所选试剂及方法均正确的是
选项 | 物质(括号内为杂质) | 除杂试剂 | 方法 |
A | 溴苯(溴) | CCl4 | 分液 |
B | 硝基苯(NO2) | NaOH溶液 | 分液 |
C | 乙烷(乙烯) | 氢气 | 洗气 |
D | 乙醇(乙酸) | NaOH溶液 | 分液 |
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃兰州一中高一下学期期末考试化学试卷(解析版) 题型:选择题
糖类、脂肪和蛋白质是维持人体生命活动必需的三大营养物质。以下叙述正确的是
A.糖类、油脂、蛋白质都是高分子化合物
B.淀粉水解的最终产物是葡萄糖
C.油脂的水解反应称为皂化反应
D.加热会使蛋白质变性,因此食用生鸡蛋所获得营养价值更高
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南长沙县一中、浏阳一中、宁乡一中高三5月化学试卷(解析版) 题型:填空题
[化学—选修3物质结构与性质](15分)
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_________区;溴的价电子排布式为____________________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
| 氟 | 氯 | 溴 | 碘 | 铍 |
第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6(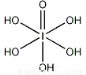 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。I3-离子的中心原子周围σ键电子对对数为_____,孤电子对对数为______, I3-离子的空间构型为___________。
与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。 A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(7)下图为碘晶体晶胞结构。有关说法中正确的是_____________。

A.碘分子的排列有2种不同的取向,2种取向不同
的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(8)已知CaF2晶体(见下图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。

查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省长沙市高三高考二模理综化学试卷(解析版) 题型:填空题
(15分)工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
A.连接好仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000g。
C.将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2 SO2 +2Cu。
SO2 +2Cu。
F.移取25.00mL含SO2的水溶液于250mL锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。

试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为 ,当产生_______________________________的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是________。
滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.04 | 21.03 |
2 | 25.00 | 1.98 | 21.99 |
3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中由一个明显的缺陷影响了测定结果(不属于操作失误),你认为是 (写一种即可)。
(5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系:c2 (H+)·(S2-) = 1 . 0×10-22 。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为1 mol/L,应调节溶液的c(H十)为__________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高一下学期期末考试化学试卷(解析版) 题型:选择题
A、B、C、D、E五种元素原子序数依次增大,且均不超过18。其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是内层电子数的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。下列说法正确的是
A.原子最外层电子数:B<A B.A与E形成的化合物是离子化合物
C.最高价氧化物对应的水化物碱性:C<D D.B与E可以形成EB2型化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com