
 某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
| ||
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
| 1 |
| 2 |
| 1 |
| 4 |
| ||
| △t |
| 转化量 |
| 加入量 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 4 |
| ||
| △t |
| ||
| 4min |
| 转化量 |
| 加入量 |
| 0.8mol |
| 4mol |
 :故答案为:加催化剂;
:故答案为:加催化剂; ;
;
| ||


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A、等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) |
| B、a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b |
| C、NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| D、某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
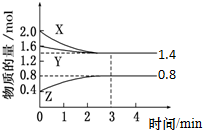 t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )
t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )| A、0~3 min,X的平均反应速率v(X)=0.1 mol?L-1?min-1 |
| B、发生反应的方程式可表示为:3 X(g)+Y(g)?2 Z(g) |
| C、3 min 时,Y的转化率为12.5%,此时,充入惰性气体Ne,转化率不变 |
| D、温度不变,增大Z的浓度,该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 卤族元素的单质和化合物很多,一氯化碘(ICl)、三氯化碘(ICl3),由于它们的性质与卤素相似,因此被称为卤素互化物.请利用所学物质结构与性质的相关知识回答下列问题:
卤族元素的单质和化合物很多,一氯化碘(ICl)、三氯化碘(ICl3),由于它们的性质与卤素相似,因此被称为卤素互化物.请利用所学物质结构与性质的相关知识回答下列问题: 和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6查看答案和解析>>
科目:高中化学 来源: 题型:
 氯气是一种重要的化工原料.如图为实验室制取氯气的装置.请回答:
氯气是一种重要的化工原料.如图为实验室制取氯气的装置.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醛是一种重要的有机原料,主要用于塑料工业、医药等.工业上可用如下方法合成甲醛:CO(g)+H2(g)?HCHO(g)△H<0.如图为一定条件下,上述反应的变化状况.
甲醛是一种重要的有机原料,主要用于塑料工业、医药等.工业上可用如下方法合成甲醛:CO(g)+H2(g)?HCHO(g)△H<0.如图为一定条件下,上述反应的变化状况.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4、NaOH、NaNO3都是电解质 |
| B、Na2O、Na2O2、Fe2O3都是碱性氧化物 |
| C、漂白粉、液氨、小苏打都是混合物 |
| D、烧碱、纯碱、熟石灰都是碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com