
| 84(m1-m2) |
| 31m1 |
| 84(m1-m2) |
| 31m1 |


科目:高中化学 来源: 题型:
| 实验步骤 | 结果分析 |
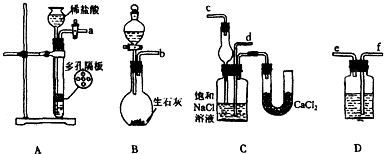
| 步骤1:取少量样品于试管中,加入适量蒸馏水使之溶解, | 若有白色沉淀生成,说明产品中含有NaCl. |
| 步骤2:另取少量样品于锥形瓶中,加入适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1盐酸滴定至溶液由红色变无色,记录消耗盐酸的体积V1. | 若 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化还原反应的特征是电子的转移 |
| B、氧化剂在反应中被还原,生成氧化产物 |
| C、同一反应中,氧化剂得电子的总数一定等于还原剂失电子的总数 |
| D、任何反应中一定有氧化剂和还原剂,且氧化剂和还原剂可以为同种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
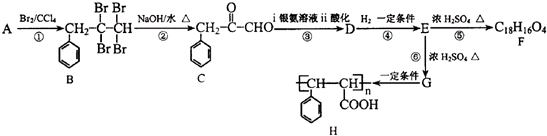
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3溶液 |
| B、AgNO3溶液 |
| C、Na2SO4溶液 |
| D、NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a+b<c |
| B、平衡向生成Z的方向移动 |
| C、Z的体积分数降低 |
| D、Y的转化率升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
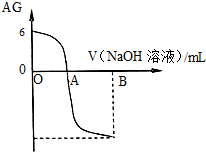 有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg| c(H+) |
| c(OH-) |
| A、A点时加入氢氧化钠溶液体积为20 mL |
| B、室温时0.01 mol/L的醋酸溶液pH=4 |
| C、OA段溶液中:c(CH3COO-)>c(CH3COOH) |
| D、若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH)+c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
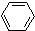 (1)+H2(g)→
(1)+H2(g)→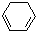 (1)-Q ①
(1)-Q ①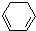 (1)+2H2(g)→
(1)+2H2(g)→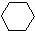 (1)+Q ②
(1)+Q ②| A、反应①、②都属于加成反应 |
| B、1,3-环己二烯比苯稳定 |
| C、反应①、②的热效应说明苯环中含有的并不是碳碳双键 |
| D、反应①、②中的所有有机物均可使溴水褪色,但褪色原理不完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com